Температура замерзании морской воды

На частицы, находящиеся в тонком слое вблизи поверхности жидкости, действуют со стороны других молекул жидкости силы, равнодействующая которых направлена внутрь жидкости по нормали к поверхности раздела. Это объясняется слабым протяжением со стороны молекул пара вследствие их резко пониженной концентрации по сравнению с жидкостью. При увеличении поверхности жидкости часть молекул… Читать ещё >
Температура замерзании морской воды (реферат, курсовая, диплом, контрольная)
Значение температуры замерзания морской воды Tf определяется ее лимитирующим эффектом; ниже температуры Tf вода не охлаждается. Поэтому на всех Т, S-диаграммах изопикны (изостеры) правильнее проводить только до линии температуры замерзания.
Для определения понижения точки плавления льда (точки замерзания чистой воды) с увеличением давления воспользуемся уравнением Клаузиуса-Клапейрона, являющегося функцией сосуществования двух фаз — воды и льда:

где X = т (п' - л*) — теплота перехода; v' и v" - удельные объемы воды и льда. Вывод уравнения (3.19.1) приводится в п. 3.18. Если в уравнение Клаузиуса-Клапейрона подставить значение абсолютной температуры Т=273К, удельные объемы воды и льда v^lOOO и v" =1091 (м3-кг'‘) и теплоту плавления, то получим:

Понижение точки замерзания раствора определяется формулой Вант Гоффа:

где N| и N0 — молярная концентрация чистого растворителя (воды) и растворенного вещества; Х'=225−18−103 Дж — теплота плавления одного моля растворителя; То=273,1К — температура плавления чистого растворителя; R = 8314 Дж-кмоль'-К'1 — универсальная (молярная) газовая постоянная. В морской воде при S=35 молярная концентрация чистой воды N0 равна == 54 моль-кг1, а основных солей Nt = 1 моль-кг1. Тогда N,/N0 =0,0185. Подставив это отношение в (3.19.2), получим, что ДТ = -1,9°С.
В современных исследованиях используется эмпирическая формула, предложенная в работе [МШего, Leung, 1976]:
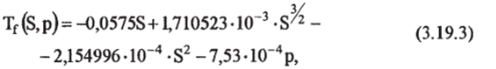
где р — давление в дбарах. Формула (3.19.3) справедлива в диапазоне практической солености от 4 до 40 и давления от 0 до 500 дбар (рис. 3.8.1).
С помощью уравнения Клаузиуса-Клапейрона значение dTf/dp.
можно экстраполировать до глубины «2700 дбар. На этой предельной глубине существований температуры наибольшей плотности температура замерзания чистой воды равна «-2°С.
Вязкость или внутреннее трение — свойство жидкостей или газов оказывать сопротивление при перемещении одного слоя относительно другого. Если же жидкость движется как единое целое, то внутреннее трение не возникает. Для выяснения сущности этого явления рассмотрим следующий элементарный опьгг. Возьмем две бесконечные плоские и параллельные друг другу пластины, расстояние между которыми равно h. Пусть верхняя пластина движется относительно нижней с постоянной скоростью и. Чтобы такое движение существовало, к жидкости в направлении движения должна быть приложена касательная сила, уравновешивающая силу внутреннего трения. Опыт показывает, что сила трения т, отнесенная к единице площади пластины, т. е. касательное напряжение, прямо пропорциональна скорости и и обратно пропорциональна расстоянию h. Вместо отношения u/h в общем случае одномерного движения можно взять отношение du/dh:


Коэффициент пропорциональности ц, который зависит от природы жидкости, называют коэффициентом динамической вязкости или просто вязкостью. Чем больше значение ц, тем больше вязкость жидкости и тем больше сила, которую надо затратить для преодоления трения между слоями для сохранения равномерного движения пластины. Выражение (3.20.1) называют законом трения Ньютона [Шлихтинг, 1969]. Часто вместо динамической вязкости применяют отношение величин вязкости и плотности, называемое кинематической вязкостью v:
Размерность динамической вязкости, очевидно, крм" 1 *с1, а кинематической вязкости м^с1. Чаще при измерении ц используется единица давления, умноженного на секунду: Н-с-м*2 или внесистемная единица — пуаз. 1 пуаз равен 0,1 Н-с*м'2, а 1 кг-м'-с1 = 9,81 Н*с-м'2.
Процесс передачи импульса от слоя с большей скоростью к другому слою зависит от конкретных особенностей межмолекулярных сил в жидкости. Очевидно, особенности структуры воды, описанные в главе 1, определяют зависимость вязкости от ее основных параметров — температуры, солености и давления. При возрастании температуры ослабевают водородные связи, следовательно, переход молекул из одного слоя в другой облегчается и значение коэффициента вязкости падает. Наличие растворенных веществ-электролитов в целом упрочняет структуру воды и повышает вязкость. Зависимость вязкости от давления — одно из проявлений аномальности воды, как отмечалось в параграфе 1.3. Вязкость «нормальных» жидкостей с увеличением давления повышается, т.к. уменьшается среднее расстояние между молекулами [Хорн, 1972]. Напротив, значение ц в морской воде при температуре менее 20 °C понижается во всех реально встречающихся в океане диапазонах давлений, и лишь при давлениях 1000−1500 бар вязкость начинает возрастать.
Наиболее точные эмпирические зависимости для вязкости морской воды приведены Звдлером и Петерсом [Siedler, Pelers, 1986]. После несложных преобразований представленных в этой работе относительных 'зависимостей значение ц для пресной воды как функции температуры будет выглядеть так:
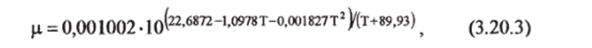
где Т — температура, °С, ц — вязкость, Н-с*м'2 Проверочное значение — 4,0387−10″ -с м 2 при Т=70°С.
В работе [Siedler, Peters, 1986] приводится полученная Миллсро зависимость вязкости р от объемной хлорносги морской воды С, которая связана с соленостью S и плотностью р (в кг-м'3) в соответствии со шкалой Кокса (3.2.5) соотношением С = (p-S)/1806,55. Выражение имеет вид:
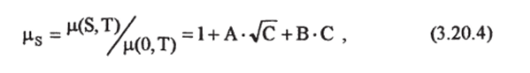
где, А = 5,185−10'5-Т + 1,0675-КГ4, В = 3,300−10'5Т + 2,591−10-3.
Зависимость вязкости от давления может быть представлена в виде поправки вида [Siedler, Peters, 1986]:
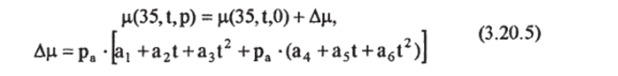
где р. = р+10,13; а,= -1,8266-КГ*; а2= 1,3817-Ю'9; а3= -2,6362−10″; а,=9,8965−10'13; а5= -6,325 10 м; а<,= 1,2115-Ю15
Хотя формула (3.20.5) разработана для океанического диапазона солености, она может применяться для солоноватых и даже пресных вод. Ошибка этой формулы относительно наблюдаемых значений при давлениях до 10 000 дбар составляет для пресной воды примерно 3%, а для воды с соленостью 35 епс не более 0,4%.
На рис. 3.20.1а представлена зависимость коэффициента динамической вязкости от солености при атмосферном давлении, а на рис. 3.20.16 — зависимость ц от давления при S=35 епс. Наибольшее влияние на вязкость, очевидно, оказывает температура: при ее повышении от 0 °C до 30 °C значение коэффициента ц падает более чем вдвое, а увеличение солености от 0 до 35 епс повышает вязкость менее чем на 20%. Влияние давления сказывается лишь при температурах ниже 5° и нс превышает 4%. Для кинематической вязкости влияние солености и давления будут еще меньше, так как одновременно со значением м аналогично изменяется и плотность воды.
Отметим в заключение, что молекулярная вязкость в реальном океане играет подчиненную роль для большинства видов движений. Исключение составляют оценка эффектов диссипации энергии в тепло, возникновение турбулентности, расчет параметров мелкомасштабной конвекции, динамика взвеси и ряд других задач. Вместо уравнения (3.20.1) для оценки переноса импульса применяется его аналог, где вместо постоянной скорости и используется осредненная за некоторый интервал времени соответствующая компонента вектора скорости течения, а коэффициент ц заменяется на так называемый коэффициент турбулентного обмена количеством движения, который превосходит динамическую вязкость на несколько порядков. Подробнее с турбулентным обменом в океане можно познакомиться в работе О. И. Мамаева [1970].
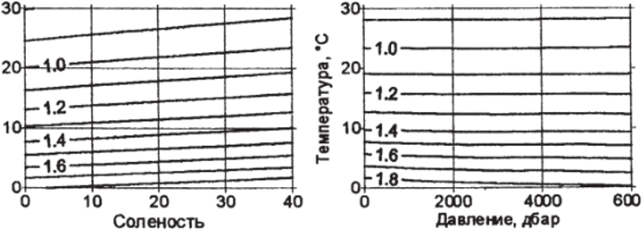
Рис. 3.20.1. Зависимость молекулярной вязкости (1(Г н*С*м') при различных температурах от: а) солености при атмосферном давлении; б) давления при солености 5=35 епс.
На частицы, находящиеся в тонком слое вблизи поверхности жидкости, действуют со стороны других молекул жидкости силы, равнодействующая которых направлена внутрь жидкости по нормали к поверхности раздела. Это объясняется слабым протяжением со стороны молекул пара вследствие их резко пониженной концентрации по сравнению с жидкостью. При увеличении поверхности жидкости часть молекул из подповерхностных слоев должна быть поднята к границе раздела. Для этого необходимо затратить работу, которая при изотермическом процессе пойдет на увеличение свободной энергии поверхности. Поскольку поверхность раздела жидкость-пар однородна, свободная энергия поверхности пропорциональна площади поверхности. В термодинамике система в изотермических условиях стремится достигнуть состояния с наименьшей свободной энергией. Поэтому поверхность жидкости стремится сократиться. Из-за этого вдоль поверхности жидкости действуют силы, называемые силами поверхностного натяжения. Численно эта сила равна плотности поверхностной свободной энергии, ее величина на 1 м2 поверхности называется поверхностным натяжением.
Поверхностное натяжение на границе с воздухом — важная характеристика интенсивности молекулярных сил в воде. По мнению Хорна [1972], в области влияния поверхностного натяжения существует зона упорядоченной структуры толщиной в несколько тысяч молекулярных слоев с более прочными водородными связями. При этом ближайший к границе молекулярный слой ориентирован к воздушной среде атомами кислорода, а плотность воды в этом слое может понижаться по сравнению с нижележащими слоями на 20−25% [Lebedev et al., 1989]. Еще одна важная особенность поверхностного микрослоя, оказывающая влияние на поверхностное натяжение — вытеснение из него ионов растворенных веществ в подповерхностные слои, приводящее к уменьшению солености.
Зависимость поверхностного натяжения от температуры вытекает из молекулярной структуры верхнего микрослоя воды. Чем выше температура, тем меньше поверхностное натяжение из-за меньшей силы взаимодействия между молекулами граничного слоя. Это уменьшение по сравнению с влиянием на динамическую вязкость невелико: при повышении температуры от 0° до 50 °C вязкость воды падает в 3 раза, а поверхностное натяжение уменьшается только на 10%. Наличие солей в малых концентрациях (порядка 0,1 епс) понижает поверхностное натяжение воды, а для реальных морских условий можно отметить его незначительное повышение (менее 1% для 35 епс) по сравнению с чистой водой [Хорн, 1972]. Наиболее точный вид зависимости поверхностного натяжения у от температуры Т (°С) можно найти в работе [Siedler, Peters, 1986]. Если объединить приведенную этими авторами формулу с зависимостью поверхностного натяжения от концентрации ионов хлора [Хорн, 1972] и использовать шкалу Кокса для солености, можно получить следующее выражение для у (Н м'1):
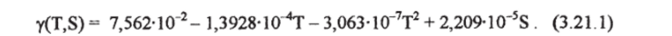
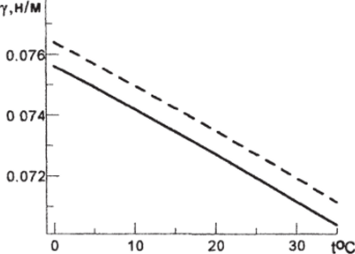
Рис. 3.21.1. Зависимость поверхностного натяжения (н/м) от температуры для пресной (сплошная линия) и морской воды при S=35 епс (пунктирная линия).
График зависимости поверхностного натяжения от температуры для пресной воды и воды с соленостью 35 епс приведен на рисунке 3.21.1.
Помимо обеднения поверхностного микрослоя солями, увеличивающими поверхностное натяжение, можно отметить и другой процесс — обогащение этого слоя веществами, уменьшающими поверхностное натяжение и, следовательно, понижающими свободную энергию поверхности. Такие вещества называются поверхностно-активными, к ним относится большинство органических пленок на поверхности океана, обязанных своим происхождением как природным биологическим процессам, так и антропогенным загрязнением.
Дня чистой океанской воды при температуре 20° характерное значение у составляет примерно 7,3* 10'2 Нм1, естественные биологические пленки понижают эту величину до (5,0−6,0)*1(Г2 Н м1, а пленка нефти на воде может уменьшить поверхностное натяжение в 3−4 раза — до (1,4−2,5)*10″ 2 Нм'1 [Попов, Федоров, Орлов, 1979]. Естественные пленки под действием ветра, волн, брызг непрерывно разрушаются и время их жизни невелико Все возрастающее загрязнение поверхностно-активными веществами (нефтяные углеводороды, моющие вещества-детергенты) приводит к появлению долгоживущих пятен и значительно изменяет протекание физикохимических и биологических процессов в океане.