Практикум.
Химия

Если гидролиз идет по трехзарядному иону, составьте уравнения гидролиза по второй ступени, повторив действия п. 1—3 и приняв за исходную соль продукт первой ступени. Учтите, что число стадий гидролиза по многозарядному иону, реально протекающих при обычных условиях, как правило, на одну меньше, чем заряд иона, так как каждая последующая стадия привела бы к образованию более сильного электролита… Читать ещё >
Практикум. Химия (реферат, курсовая, диплом, контрольная)
Контрольные вопросы и задания.
- 1. Опишите растворы как гомогенные системы.
- 2. Дайте определения способам выражения состава растворов: массовая доля, молярная и молярная концентрация эквивалентов.
- 3. Охарактеризуйте свойства разбавленных молекулярных растворов: понижение давления пара растворителя, повышение температуры кипения, понижение температуры замерзания, осмотическое давление.
- 4. Охарактеризуйте растворы электролитов, их отличия от молекулярных растворов.
- 5. Приведите основные положения теории электролитической диссоциации Аррениуса и сольватной теории Менделеева.
- 6. Дайте определение степени диссоциации электролитов. Как подразделяют электролиты по степени диссоциации? Приведите примеры ступенчатой диссоциации многоосновных кислот и многокислотных оснований.
- 7. Охарактеризуйте диссоциацию слабых электролитов как обратимый процесс. Приведите вывод уравнения закона разбавления Оствальда.
- 8. Объясните, почему константа диссоциации сильных электролитов изменяется с изменением концентрации.
- 9. Чем определяется направленность реакций в растворах электролитов? Приведите формулировку правила Бертолле.
- 10. Охарактеризуйте воду как слабый электролит константой диссоциации. Что такое водородный показатель? Как он характеризует кислотность раствора?
- 11. Дайте определение произведению растворимости (ПР) как показателю, характеризующему равновесие между осадком малорастворимого вещества и насыщенным раствором.
- 12. Что такое дисперсная система, дисперсная фаза и дисперсионная среда? Приведите классификацию дисперсных систем по агрегатному состоянию фаз. Приведите примеры дисперсных систем.
- 13. Дайте определение и приведите примеры лиофобных и лиофильных дисперсных систем.
- 14. На примере рассмотрения границы раздела фаз жидкость — газ объясните, что такое свободная поверхностная энергия и поверхностное натяжение.
- 15. Опишите поверхностные явления — адсорбцию и десорбцию. Дайте определения понятиям: адсорбент, адсорбат, адсорбтив.
- 16. Опишите строение коллоидной частицы на примере AgCl, полученного при избытке AgN03.
- 17. Объясните механизм возникновения и строение двойного электрического слоя на поверхности коллоидных частиц.
- 18. Опишите методы получения коллоидных растворов.
- 19. Объясните что такое коагуляция и седиментация коллоидных растворов, как их вызвать и как предотвратить.
- 20. Опишите оптические и кинетические свойства коллоидных растворов.
Примеры выполнения заданий.
1а. Определите массу кристаллогидрата CuS04 • 5Н20, необходимого для приготовления 50 г 10%-ного раствора сульфата меди. Какой объем воды необходим для приготовления этого раствора?
Дано: Решение.
mp.pa = 50 г Найдем массу безводной соли в 50 г 10%-ного раствора:
C0(CllSO4) = 10% до _ -an j qqo/.
^*p-pa.
_ m (CuS04) = 50 • 0,1 = 5 ®.
Найти:, W (CuS04) = 64 + 32 + 4 • 16 = 160 (г/моль).
К (Н20) Найдем количество вещества CuS04: и = m/M,
m (CuS04 • 5Н, С)) u (CuS04) = 5/160 = 0,031 (моль).
Найдем массу кристаллогидрата, содержащего 5 г безводной соли: 1 моль CuS04 • 5Н20 содержит 1 моль CuS04,.
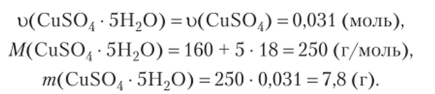
Найдем объем воды, необходимый для приготовления раствора:  Ответ: m (CuS04 • 5Н20) = 7,8 г; У (Н20) = 42,2 (мл).
Ответ: m (CuS04 • 5Н20) = 7,8 г; У (Н20) = 42,2 (мл).
16. Приведите расчет для приготовления 200 мл 0,3 и раствора сульфата никеля из имеющегося в лаборатории NiS04 • 7Н20 и воды.
Дано: Решение.
CM(NiS04) = 0,3 моль-экв/л т
п _ шв-ва Ура = 200 мл = 0,2 л_ "
Найти: w (NiS04 • 7Н20).
Найдем массу соли NiS04 • 7Н20. Так как 1 моль кристаллогидрата содержит 1 моль безводной соли, то при приготовлении растворов заданной молярной концентрации эквивалентов, расчет ведут, но молярной массе кристаллогидрата.
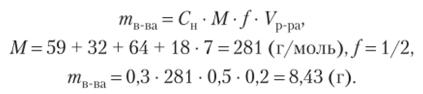
Растворы молярной концентрации эквивалентов готовят в мерных колбах заданного объема, поэтому объем добавляемой воды не рассчитывают. Ответ: m (NiS04 • 7Н20) =8,43 г.
1 В. Какой объем 15%-ного раствора карбоната натрия (р = 1,10 г/мл) необходим для приготовления 120 мл 0,45 М раствора?
Дано: Решение.
co (Na2CO;}) = 15%.
ш _ Д^ва.. 1 оо%, v = —,
^р-ра Р р (15% р-ра) = 1,1 г/мл т
б-м = ТГТГ — (см. приложение 1).
М * ^р-ра.
P (0,45 M p-pa) = M (Na2COj) = 2 • 23 + 12 + 3 • 16 = 106 (г/моль).
= 120 мл = 0,12 л См = 0, 45 моль/л Масса безводного Na2C03 в 120 мл 0,45 М р-ра:
Найти: У15о/о|).ра m (Na2C03) = 0,45? 106 0,12 = 5,72 (г).
Найдем, в какой массе 15%-ного раствора содержится 5,72 г карбоната натрия: 
Ответ: Р15%р.ра = 34,67 мл.
1 г. Какая масса соли необходима для приготовления 200 мл раствора с молярной концентрацией эквивалента 0,3?
Дано: Решение.
СН(А1СЦ) = 0,3 моль-экв/л.
V" m = 200 мл = 0,2 л С" =—.
р ра " Мf-V
л 1 J р-ра Найдем массу соли: тв вл = Сн — М? f? V ра, jV/(A1C13) = 27 + 3 • 35,5 = 133,5 (г/моль); /(А1С13) = 1/3;
_ т (А1С13) = 0,3 • 133,5 • 0,2 • 1/3 = 26,7 (г).
Найти: т (А1С13).
Ответ: от (А1С13) = 26,7 г.
2. Составьте выражения констант диссоциации для угольной и сернистой кислот. Пользуясь таблицей 7, определите, какая из них является более слабым электролитом. Рассчитайте степень диссоциации сернистой кислоты в 0,001 М растворе. 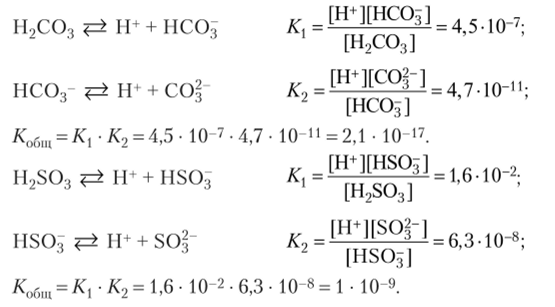
Из сравнения значений констант диссоциации угольной и сернистой кислот очевидно, что угольная кислота более слабая (/С (Н2С03)< /C (H2S03)).
Дано: Решение.
/C (H2S03) = 1 • 10 9 пт
См = 0,001 моль/л = 10 моль/л п= |— = I-= Ю-3
V С V ю-3
Найти: a (H2S03) Ответ: a = 10 3.
3. Составьте выражения ПР гидроксидов магния и железа (Н), пользуясь приложением 6, сравните их растворимость.
В насыщенных водных растворах труднорастворимых веществ устанавливаются гетерогенные равновесия между осадком и ионами электролита в растворе:
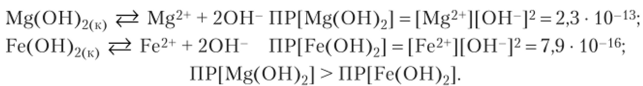
Растворимость гидроксида магния больше растворимости гидроксида железа (П).
4. Произведение растворимости AgI03 равно 3,2 • 10~8 при 25 °C. Рассчитайте молярную концентрацию AgI03 в его насыщенном при данной температуре растворе.
Дано: Решение.
nP (Ag!Q3) = 3,2 • 10 8 AgI03(K) Ag+ + Ю3
Найти: См Находим молярную концентрацию AgI03 в его насыщенном растворе над осадком:
ПР = [Ag+][I03],.
CM(AgI03) = | Ag+| = [I ()3] = л/ПР=л/3,2 10-8 =.
= 1,79 • 1(H (моль/л).
Ответ: См = 1,79 • 10 4 моль/л.
6. Какие из указанных солей подвергаются гидролизу: нитрат лития, сульфат хрома (Ш), ортофосфат натрия, сульфид хрома (Ш)? Приведите ионные и молекулярные уравнения гидролиза, укажите реакцию среды и условия смещения равновесия.
Гидролизу подвергаются те растворимые соли, которые образованы слабым основанием (гидролиз по катиону) или слабой кислотой (гидролиз по аниону), так как лишь взаимодействие их ионов с водой приводит к образованию слабого электролита (связыванию ионов) и смещению ионного равновесия диссоциации воды.
Алгоритм составления уравнений обратимого гидролиза
- 1. Составьте краткое ионное уравнение взаимодействия одного иона слабого электролита с одной молекулой воды. Укажите pH раствора соли (больше или меньше 7), а также влияние подкисления или подщелачивания среды на смещение равновесия гидролиза (в соответствии с принципом Ле-Шателье).
- 2. Составьте полное ионное уравнение, приписав к левой и правой частям уравнения формулы ионов сильного электролита, не участвующих в гидролизе.
- 3. Составьте молекулярное уравнение гидролиза соли по первой ступени, при необходимости расставьте коэффициенты.
- 4. Если гидролиз идет по трехзарядному иону, составьте уравнения гидролиза по второй ступени, повторив действия п. 1—3 и приняв за исходную соль продукт первой ступени. Учтите, что число стадий гидролиза по многозарядному иону, реально протекающих при обычных условиях, как правило, на одну меньше, чем заряд иона, так как каждая последующая стадия привела бы к образованию более сильного электролита.
Решение.
LiN03 — соль образована сильным основанием (LiOH) и сильной кислотой (HN03), гидролизу не подвергается, так как ионы Li+ и N03 не образуют с водой слабых электролитов, pH = 7.
Cr2(S04)3 — соль образована слабым основанием (Сг (ОН)3) и сильной кислотой (H2S04), гидролиз по катиону.
I ступень Сг3+ + НОН CrOH2+ + Н* pH < 7.
Cr3+ + SO^ + НОН [СгОН]2+ + н+ + SO^.
Cr2(S04)3 + 2НОН ^ 2[Cr0H]S04 + H2S04
II ступень [CrOH]2+ + НОН <=" |Cr (OH)2]+ + Н*.
[CrOH]2+ + SO^ + НОН [Cr (OH)2] * + H+ + SOf 2[Cr0H]S04 + 2HOH <=" [Cr (OH)2]2S04 + H2S04
Но третьей ступени гидролиз практически не идет, так как это привело бы к образованию более сильного электролита Сг (ОН)3, чем Сг (ОН)2.
Усилить гидролиз можно связыванием протонов в воду, т. е. добавлением щелочи, а также нагреванием и разбавлением раствора. К смещению равновесия гидролиза влево приведет добавление кислоты.
Na3P04 — соль образована сильным основанием (NaOH) и кислотой средней силы (Н3Р04), гидроанионы которой являются слабыми электролитами (гидролиз по аниону).
I ступень РО^ + НОН ?=> HPOf + ОН pH > 7.
РО|- + Na+ + НОН ^ НРО|- + Na+ + ОН Na3P04 + НОН ?=> Na2HP04 + NaOH.
II ступень HPOf + НОН Н, Р04 + ОН.
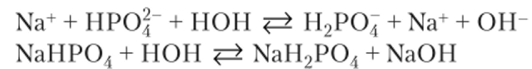
Усиление гидролиза возможно при добавлении кислоты, нагревании, разбавлении. Подщелачивание среды приведет к смещению равновесия влево.
По третьей ступени гидролиз при обычных условиях практически не идет, так как Н3РО4 более сильный электролит, чем IT2POj.
Cr2S3 — соль образована слабым многокислотным нерастворимым основанием (0(011)з) и слабой многоосновной летучей кислотой (II2S). Такие соли подвергаются полному необратимому гидролизу. При этом сразу образуются конечные продукты гидролиза — осадок слабого основания и летучая кислота.
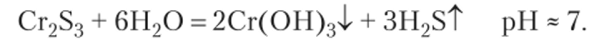
7а. Определите давление пара раствора при 40 °C, содержащего 3,6 г глюкозы в 250 г воды. Давление пара воды при той же температуре равно 55,32 мм рт. ст.
Дано: Решение.
/Wj (глюкозы) = 3,6 г о _ рО п 1Ъ
т2(Н20) = 250 г По закону Рауля: -L-^L = —, или Р] = р2? —j—.
_ r— Pi п2 П П2 ^п
р2 — ЪЪЛ ММ рт. ст. Найдем число молей C6HI206(WI) и Н20(и2):
Найти:/?, п = т/М
М (С6Н1206) = 180 (г/моль); пл = 3,6: 180 = 0,02 (моль).
М (Н20) = 18 (г/моль), п2 = 250: 18 = 13,89 (моль);
/?, = 55,32 • 13,89/(13,89 + 0,02) = 55,24 (мм рт. ст.). Ответ: /?, = 55,24 мм рт. ст.
76. Определите температуру замерзания раствора, содержащего 0,8132 г нафталина в 25,46 г бензола. Температура замерзания бензола 5,5°С, а его криоскопическая постоянная равна 5,12.
Дано: Решение.
wi (cioH8> = 0,8132 г АТ3 = ЕЯСМ;
m2(C(iH6) = 25,46 г m -1000? 1000.
t3 = 5,5°С См=-^-Дr = -i—-.
?, = 5,12_ iW, i, • «*р-ля мР.п? тР-ля
Найти: t.a раствораМ (С,0Н8) = 128 г/моль, ДГ, = 5,12 • 0,8132 • 1000/25,46 • 128 = 1,277 СС);
Д .1 —з — ^(з. ра-ра), ^(з. ра-ра) —з — Д t<3. pa-pa) = 5,5 — 1,277 = 4,223 (°С).
Ответ: раствор замерзает при 4,223°С.
7 В. Определите массовую долю мочевины в водном растворе, если его температура кипения 100,174°С. Эбуллиоскопическая постоянная воды равна 0,512.
Дано: Решение.
- 1= т, 1ГС Шр.в-Ю00 _ Ек — от 1000
- ?к = 0,512 ДТк = ЕКСМ, См = —1-, ДТ = -•
^р.в *р-ля ^р.в 'р-ля для 100 г раствора тп".т = 100 — тр _Л/[СО (МН2)2] = 60 г/моль.
Найти: ю%р в АТК = 100,174 — 100 = 0,174 (°С).
0,512-m -1000.
Из уравнения 0,174=——-L-— находим т"
(100-/ирв)-60.
трв = 2 г., т. е. в 100 г раствора — 2 г мочевины или 2%.
Ответ: раствор содержит 2% мочевины.
Задания для самостоятельного решения.
- 1. Решите расчетную задачу.
- 1. Сколько граммов Na2C03 содержится в 500 мл 0,25 н раствора?
- 2. Какая масса КС1 потребуется для приготовления 250 мл 0,15 М раствора?
- 3. Найдите массу NaN03, необходимую для приготовления 150 мл 2 М раствора.
- 4. В каком объеме 0,1 н CuS04 содержится 8 г безводной соли?
- 5. В каком объеме 0,3 М раствора NaCl содержится 2 г соли?
- 6. Определите молярную концентрацию раствора, содержащего 11,2 г КОН в 200 мл раствора.
- 7. Определите молярную концентрацию раствора Na2S04, содержащего 42 г соли в 300 мл раствора.
- 8. Вычислите молярную концентрацию Ва (ОН)2 в растворе, если в 2 л его содержится 2 г щелочи.
- 9. Сколько граммов NaBr потребуется для приготовления 700 мл 0,15 н раствора соли?
- 10. Какая масса КС1 потребуется для приготовления 250 мл 1,15 М раствора соли?
- 11. Найдите массу NaOH, необходимую для приготовления 2 л 0,3 н раствора.
- 12. В каком объеме 2 М раствора NaCl содержится 5 г соли?
- 13. Какова молярная концентрация эквивалентов раствора, содержащего 9 г СаС12 в 500 мл раствора?
- 14. В каком объеме 0,1 н раствора СиС12 содержится 5 г соли?
- 2. Составьте уравнения диссоциации соединений, формулы которых приведены ниже. В тех случаях, где это необходимо, приведите уравнения ступенчатой диссоциации. Составьте выражения констант диссоциации предложенных кислот. Какая из двух является более слабой? Рассчитайте степень диссоциации одной из кислот в 0,01 М растворе.
Вариант. | ||||||||
Кислоты. | нею Н3В03 | НЖ)2 H2Se. | H2S. ню. | H3BC>3. IIBrO. | нсю2 H2co3 | H2S ()3 Held. | HBrO. H2co3 | HIO. h3po4 |
Вариант. | ||||||||
Кислоты. | О о. хо | H2S03 hno2 | H2S. соон. | Н3ВО3. hno2 | H3P04 HC102 | нею. H2S. | H2Se. CH3COOH. | |
3. Составьте выражения ПР указанных веществ, сравните их растворимость. Рассчитайте концентрацию катионов и анионов в насыщенном растворе одного из этих веществ.
Вариант. | ||||||||
Вещества. | AgBr. AgCl. | Mg (OH)2 Mgs. | CaS04 BaS ()4 | Agl. AgCl. | FeS. CuS. | SrS04 BaS ()4 | CdS. CuS. | AgBr. Agl. |
Вариант. | ||||||||
Вещества. | СаСО). CaS04 | Hgs. CuS. | FeS. Fc (OH)2 | Cul. Agl. | CuCl. Cul. | Cu (OH)2 CuS. | Zn (OH)2 ZnS. | |
4. Рассчитайте концентрацию ионов ОН-, а также pH раствора, укажите реакцию среды при указанной концентрация ионов Н+.
Вариант. | [H+],. | чоль/л. | Вариант. | |H+],. | моль/л. | Вариант. | [Н+],. | моль/л. |
3,82. | 10 12. | 9,12. | • 10 5 | 7,55. | • 10-7 | |||
2,85. | • 10-2 | 6,38. | lO-io. | 4,52. | • Ю-з. | |||
2,88. | • 10−6. | 8,85. | 10-И. | 3,33. | • Ю-з. | |||
5,28. | 10−13. | 8,32. | • 10 6 | 1,86. | юн. | |||
7,56. | • 10 1. | 6,25. | • 10 9 | 8,84. | 10 12. |
5. Приведите молекулярные и ионные уравнения тех реакций, которые возможны в растворе, объясните их направленность.
Вариант. | Схемы реакций. | Вариант. | Схемы реакций. |
Cu (()H)2 + Na2S04—> Na2S04 + ВаС12 -" Fe (OH)-) + H2S04 Al (OH)3 + NaOH-> РЬ (М03)2 + H2S -«. | NaOH + CaC ()3-> CaS04 + SrCl2 -" Cu0H2S04 + HCI -> Cu (N03)2 + II2S —> CuCl2 + AgN03 -> | ||
Н2С03 + Ca (N03)2 -> NaCl + LiNO3 Cr (OH)3 + КОН -> Na2C03 + HCI -> Са (НС03)2 + Са (ОН)2 | KCI + H2S04 -> (Ni0H)2S04 + HCI -> Pb (N03)2 + Cu (OH)2 Na2C03 + Ca (N03)2 -> NH4N03 + NaOH -> | ||
СаС03 + LiCl -> K2S + MCI -> Mg (OH)2 + Na2S04 -" (Fc0H), S04 + h, so4 -> Pb (OII)2+ lIN03-> | Pb (OH)2 + KOH -> H2S + FeCI2 -> ZnS04 + Cu (OH)2 -> NaH, P04 + NaOH -> CaCl" 2 + Na2C03 -> | ||
Cu (N03)2 + BaS04 -> Ba (OH)2 + H2S04 —" CuS04 + KCI -> Be (OH)2 + KOH -> Ba (HC03)2 + NaOH -> | HN ()3 + K2S04 -> Al (OH)3 + KOH -> KOH + Na2S04 -> CaC03 + H20 + C02 -> BaS + CuS04 -> |
Вариант. | Схемы реакций. | Вариант. | Схемы реакций. |
Ве (ОН)2 + КОН -> FeOHCl2 + НС1 -> Na2S04 + К2С03 —> NaN03 + Zn (OH)2 -> CaCl2 + H2S04 -> | Na2Si ()3 + HC1 -> Cr (OH)3 + HN03 -> CuCI2 + KN03 CrOHS04 + h2so4 -> AgN03 + CuCl2 -> | ||
Ba (NOo)2 + Na2S04 -> CuOHCl + NaOH^ KNO-, + Na2C03 -> A1(()H)3 + KC1 -" Na2C03 + H2S04-> | CaS + HC1 -> CoCl2 + KOH -> Pb (N03)2 + KC1 -> Be (OH)2 + Ba (OH)2 -> NaN03 + H2S04 -«. | ||
BaCl2 + H2S04 Na3P04 + H2S -> NaOH + Л1С1-, -> Pb ()HN03 + HN ()3 -> Na2S + KC1 -> | 1−1. | k2so4 + h2so3 -> BaS + CuS04 ->? Al (OH)3 + NaCl -> SrS04 + CaCl2 -" Cr (OH)3 + NaOH -> | |
Be (()H)2 + КОН -> HN03 + CaS -> NaHS04 + NaOH -> | AgN03 + CaCl2 —> KBr + Zn (OH)2 -> | ||
6. Составьте молекулярные уравнения реакций, соответствующие следующим кратким ионным.
Вариант. | Краткое ионное уравнение. | Вариант. | Краткое ионное уравнение. |
i. | Ы2Р ()4 + ОН = НРО| +. + н2о РЬ2+ + SOf = PbS04l [Cr (OH)2]+ + 2Н" = Cr3+ + + 21120 '. | 3Ag- + РОГ = Ag3P044 НС03 + ОН = со] + н., о ВаСОэ + 211+ = Ва2+ +. + co2t + Н20. | |
|Fe (OH)2j+ + 2H+ = Fc3+ + + 2H20. H2S + 2Ag+ = Ag2Si + 2H+ CO^ + 2H+ = C02T + H20. | HAsOf + ОН- = As04" +. + Н20. [А1()Н]2+ + Н+ = А13+ + Н2() 2Н+ + S2— = H2St. | ||
hco3 + H+ = H20 + co2T Ni (OH)2 + 2H+ = Ni2+ + 2H-, 0 CO§ + Ca2+ = CaC034; | FeOH2+ + 2011 = Fe (OH)34- MgC03 + 2H' = Mg2+ +. + C02t + H20 Cu2+ + S2 = CuS4; | ||
SO|- + 2H+ = S02t + H20 [Cu ()H]+ + H+ = Cu2+ + H2() 3Ca2+ + 2P04 = Ca3(P04)2l. | H2S + Pb2+ = PbS4> + 2H+ BaS03 + 2H+ = Ba2+ + S02t + + H20. [Fe (OH)2]+ + OH =. = Fe (OH)34; |
Вариант. | Краткое ионное уравнение. | Вариант. | Краткое ионное уравнение. |
Н2Р04 + 20Н-= POf + + 2Н20. РЬ2+ + 21- = РЫ24- СаС03 + 2Н- = Са2+ +. + С02Т + Н20. | Pb2+ + 2ВГ = PbBr2J; HS + он- = s2— + h9o. BaSe03 + 2H+ = Ba2+ + + Sc02t + H20. | ||
HS ()3 + ОН = so| + н2о Ag+ + 1= AglJСо (ОН)2 + 2Н+ = Со2+ +. + 2Н20. | [Fe ()H]+ + OH = Fe (()H)24- Sr2+ + SOf = SrS044- SO|- + 2H+ = H20 + S02t. | ||
3Ba2+ + 2POf = Ва3(Р04)21 HSc- + Н* = H2Sc Ag* + Br~ = AgBri. | (CuOH)+ + H+ = Cu2+ + H20 H2S + 2Ag+ = Ag, Si + 2H+ H2As04 + 20H =2H20 +. + AsOij. | ||
Hg2+ + S2— = HgSl, [Al (OH),]+ + 2H+ = Al3+ + 2H, 0, H+ + OH- =. = n2o. | |||
в растворе, pH которого.
7. Рассчитайте концентрацию ионов Н+ и ОН приведен в таблице.
Вариант. | ||||||||
pH. | 4,3. | 10,8. | 2,6. | 12,5. | 8,3. | 11,6. | 1,8. | 6,7. |
Вариант. | ||||||||
pH. | 9,4. | 3,8. | 9,3. | 2,3. | 13,2. | 5,6. | 1,1. | |
8. Какие из указанных солей подвергаются гидролизу? Приведите молекулярные и ионные уравнения гидролиза, укажите реакцию среды и условия смещения равновесия гидролиза.
Вариант. | Названия солей. |
Фосфат калия, сульфат меди (Н), хлорид рубидия, сульфид алюминия. | |
Ацетат аммония, нитрат хрома (Ш), карбонат лития, сульфат цезия. | |
Нитрат натрия, сульфид бария, хлорид железа (Ш), сульфид железа (Ш). | |
Хлорид бария, сульфид натрия, сульфат мсди (П), карбонат хрома (Ш). | |
Сульфит калия, нитрат кобальта (П), нитрат калия, сульфид хрома (Ш). | |
Иодид лития, сульфит натрия, нитрат алюминия, карбонат аммония. |
Вариант. | Названия солей. |
Ацетат натрия, сульфат железа (П), карбонат алюминия, бромид калия. | |
Нитрат свинца (П), нитрит аммония, сульфат калия, карбонат натрия. | |
Хлорид цинка, нитрат бария, сульфид алюминия, ацетат меди (П). | |
Нитрит кальция, нитрат никеля (И), карбонат железа (Ш), хлорид рубидия. | |
Бромид калия, сульфид натрия, хлорид меди (П), сульфид хрома (Ш). | |
Нитрат меди (П), сульфид кальция, нитрат стронция, сульфид аммония. | |
Хлорид меди (Н), фосфат цезия, сульфат калия, сульфид железа (Н). | |
Нитрат натрия, хлорид бериллия, фосфат калия, сульфит аммония. | |
Сульфат алюминия, нитрит бария, хлорид калия, сульфид алюминия. |
9. Приведите молекулярные и краткие ионно-молекулярные уравнения реакций, с помощью которых можно осуществить следующие превращения, укажите условия их протекании.
Вариант. | Превращения. | Вариант. | Превращения. |
ВаС03 —> Ba (HCOj)-, —". -> ВаС03 Fe20:) -> Fc (OH)3 Си -" CuS04 Cu (NO,), -> CuOHNO-j -> Cu (N03)2 -> -> Na2S ()4 -> NaCl. | ZnO -> Zn (OH)2 Ca3(P04)2 -> CaIIP04 —" -> Ca3(P04)2 FeCl3 -> FeOHCl2 -> FeCl3 KN03 -> HN03 Fe -> FeCl2 | ||
Hg ->? Hg (N03)2 ZnS04 -> (Zn01I)2S04 -> -> ZnS04 Na3P04 -> NaCl K., S03 -> KHSO-j -> k, so3 MgO -> Mg (OIlj2 | KC1 -> KN03 Cu -> CuCl2 PbO -> Pb (OH)2 MgC03 Mg (IIC03)2 -> —> MgC03 AICI3 -> A1(011)2C1 -> AICI3. | ||
Fc -> Fe (N ()3)2 CuS04 -> CuCl2 Al2()3 -> Al (()H)3 FeCl2 -> FeOHCl -> FeCl2 | K2S -> KHS -> K2S CuO -> Cu (OH)2 Cr2(S ()4)3 -> CrOHS04 -> Cr2(S04)3 |
Вариант. | Превращения. | Вариант. | Превращения. |
к3ро4 -> кн2ро4 -> к3ро4 | KC1 -> ПС1 Al —> AI2(S04)3 | ||
Cr (N03)3 -> CrOH (N ()3)2 -> -> Cr (N03)3 SnO —" Sn (OH)2 к2со3 -" кнсо3 -> к2со3 К3Р04 ^ KN03 Си -" Cu (N03)2 | Fe -> FeCl3 Ba3(P04)2 —> Ba (H2P04)2 -> —> Ba3(P04)2 FeO -> Fe (OH)2 A1C13 -> A10HC1, -> A1C13 K2S04 -> KC1. | ||
МпО -? Мп (ОП)2 Al2(S04)3 —> [Al (OH)2]2S04 —> A12(S04)3 ВаС12 -> Ва (Ы03)2 СаС03 -> Са (НС03)2 -> —^ СаСОэ Mg -> Mg (N03)2 | ZnCl2 —> ZnOIICl -> ZnCl2 Na2S03 -> NaHS03 -> -" Na2S03 Cr203 -> Cr (OH)3 CuS04 -> Cu (N03)2 Fc -" FeS04 | ||
Na3P04 -> NaH2P04 -«. -> Na3P04 NiO —> Ni (OH)2 A1(N03)3 -> A1(0H)2N03 -> -" A1(N03)3 Ag -" AgN03 NaN03 -> Na2S04 | CoO -> Co (OH)2 Al2(S04)3->[Al (0H)2]2S04-> Al2(S04)3 KC1 -> K2S04 Al -> A1C13 Na2C03 -> NaHC03 -> —> Na2C03 | ||
CrCl3 -" Cr (OH)2Cl -> CrCl3 BeO-*Be (OII)2 Na2S04 -> NaN03 Zn —> Zn (N03)2 Mg3(P04)2 -? Mg (H2P04)2 -> -«• Mg3(P04)2 | Na2S -> NaHS -> Na2S Fe203 —" Fe (OII)3 Pb (N03)2 -> PbOHNOj -> -" Pb (N03)2 kno3 -> k2so4 Al -> A12(S04)3 | ||
PbO -> Pb (OH)2, K3P04 -> KC1, Pb -> Pb (N03)2 CaS03 -> Ca (HS03)2 -> CaS03, Fe2(S04)3 -> FeOHS04 -«• Fe2(S04)3 | |||
- 10. Решите расчетную задачу.
- 1. Раствор 7,252 г глюкозы в 200 г воды замерзает при -0,378°С. Криоскопическая постоянная воды равна 1,86. Определите молекулярную массу глюкозы.
- 2. Давление пара воды при 80 °C равно 355,1 мм рт.ст. Рассчитайте давление пара над раствором, содержащим 6 г мочевины (CO (NH2)2) в 180 г воды.
- 3. При какой температуре замерзнет раствор 0,022 моль глюкозы в 100 г воды? Криоскопическая постоянная воды равна 1,86.
- 4. Определите относительное понижение давления пара над раствором, содержащим 4,14 г салициловой кислоты (С7Н603) в 100 г этилового спирта.
- 5. Определите температуру замерзания раствора 0,625 г мочевины (CO (NH2)2) в 50 г воды. Криоскопическая постоянная воды равна 1,86.
- 6. Давление пара бензола (С6Н6) при 20 °C равно 75,18 мм рт. ст. Вычислите давление пара над раствором, содержащим 0,514 г дифениламина (С6Н5)2МН в 50 г бензола при этой температуре.
- 7. Определите температуру замерзания раствора, содержащего 1,205 • 1023 молекул неэлектролита в 1 л воды. Криоскопическая постоянная воды равна 1,86.
- 8. Какова массовая доля фруктозы (С6Н,206) в водном растворе, который замерзает при -0,524°С? Криоскопическая постоянная воды равна 1,86.
- 9. Давление пара воды при 50 °C равно 92,5 мм рг. ст. Сколько моль глюкозы надо растворить в 270 г воды, чтобы давление пара над раствором понизилось на 0,5 мм рт. ст.
- 10. Вычислите давление пара воды над 5%-ным водным раствора глицерина (С3Н803) при 25 °C. Давление пара воды при этой температуре равно 23,76 мм рт. ст.
- 11. Определите температуру замерзания раствора 0,8 г мочевины (CO (NH2)2) в 80 г воды. Криоскопическая постоянная воды равна 1,86.
- 12. Вычислите температуру кипения водного 1%-ного раствора глицерина (С3Н803). Эбуллиоскопическая постоянная воды равно 0,512.
- 13. Вычислите молекулярную массу бензальдегида, если раствор 1,612°г его в 100 гэфира (С4Н10О) кипит при 34,806°С. Температура кипения эфира 34,5°С, а эбуллиоскопическая постоянная его равна 2.
- 14. Давление пара раствора, содержащего 0,425 г анилина в 100 г эфира (С4Н10О), при 20 °C равно 440,9 мм рт. ст. Давление пара над чистым эфиром при той же температуре — 442,4 мм рт. ст. Определите молекулярную массу анилина.
- 15. Давление пара бензола (С6Н6) при 20 °C равно 75,18 мм рт. ст. Вычислите давление пара над раствором, содержащим 0,4 г анилина (CgH7N) в 50 г бензола при этой температуре.
Тест для самоконтроля.
- 1. Количество моль вещества в единице объема раствора — это:
- 1) молярная концентрация;
- 2) нормальная концентрация;
- 3) массовая доля.
- 2. Отношение массы растворенного вещества к массе раствора — эго:
- 1) массовая доля;
- 2) нормальная концентрация;
- 3) молярная концентрация.
- 3. Растворимость газа пропорциональна его парциальному давлению над раствором — это:
- 1) закон Генри;
- 2) закон Рауля;
- 3) закон Вант-Гоффа.
- 4. Какая кислота относится к сильным электролитам?
- 1) H2S;
- 2) Н20;
- 3) НС1.
- 5. Какая реакция не возможна в растворе?
- 1) Ве (ОН)2 + 2КОН = К2[Вс (ОН)4];
- 2) КОН + IIN03 = KN03 + Н20;
- 3) КОН + NaN03 = KN03 + NaOII.
- 6. Отрицательный логарифм концентрации ионов водорода в растворе — это:
^нестойкости'.
- 2) ПР;
- 3) pH.
- 7. Автором гидратной теории растворов является:
- 1) С. Аррениус;
- 2) Д. И. Менделеев;
- 3) Н. К. Курнаков.
- 8. Электролиты, при диссоциации которых в качестве анионов образуются только ОНионы, — это:
- 1) кислоты;
- 2) основания;
- 3) соли.
- 9. Молекулы какого вещества подвергаются в растворе ступенчатой диссоциации?
- 1) Na2S04;
- 2) НВг;
- 3) H2S03.
- 10. Выражением какого закона является уравнение Кл = а2с?
- 1) закона Рауля;
- 2) закона Вант-Гоффа;
- 3) закона Оствальда.
- 11. Какая система является дисперсной?
- 1) раствор сахара;
- 2) минеральная вода;
- 3) молоко.
- 12. Какой частицей, согласно теории строения коллоидных растворов, является мицелла?
- 1) электронейтральной;
- 2) отрицательно заряженной;
- 3) положительно заряженной.[1]
- 14. Как называется процесс укрупнения частиц, приводящий к потере устойчивости золя?
- 1) Седиментация;
- 2) коагуляция;
- 3) электрофорез.
- 15. Кто открыл рассеяние света частицами дисперсной фазы коллоидного раствора, являющееся следствием коллоидной степени дисперсности этих частиц?
- 1) Броун;
- 2) Тиндаль;
- 3) Рейсс.
Ответы к тесту
Номер вопроса. | |||||||||||||||
Номер ответа. |
Лабораторная работа № 6 Часть I. Сильные и слабые электролиты Цели работы: изучить электрическую проводимость растворов электролитов и влияние на нее различных факторов.
Реактивы: 1 н растворы соляной кислоты, уксусной кислоты, гидроксида натрия и гидроксида аммония.
Оборудование: источник питания постоянного тока, миллиамперметр, графитовые электроды в деревянном футляре (карандаши) с проводами и контактами, четыре стаканчика (100 мл), промывал ка с дистиллированной водой, мерный цилиндр.
Ход работы.
1. Соберите цепь, последовательно присоединив электроды к миллиамперметру и источнику постоянного тока (рис. 7.10).
Налейте в четыре стаканчика 1 н растворы: HCl, СН3СООН, NaOH, NH4OH. Опустите электроды поочередно в стаканчики с указанными растворами, замыкая цепь и записывая показания амперметра в таблице. При переходе от одного раствора к другому электроды необходимо промыть дистиллированной водой и высушить фильтровальной бумагой.
Экспериментальные данные электропроводности растворов.
1 н растворы веществ. | Показания миллиамперметра, мА. | Степень диссоциации (справочные данные). |
НС1. | ||
сн3соон. | ||
NaOH. | ||
NH4OH. |
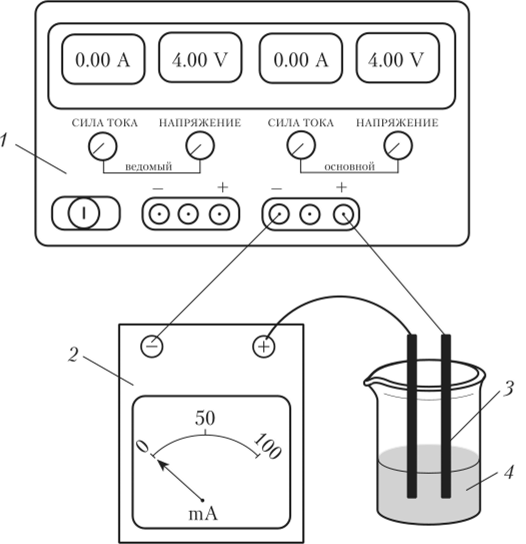
Рис. 7.10. Схема установки для определения удельной электропроводности растворов электролитов:
- 1 — источник питания постоянного тока; 2 — миллиамперметр;
- 3 — графитовые электроды в деревянных футлярах («карандаши»);
- 4 — исследуемый раствор
Сравните электропроводность исследованных кислот и оснований. Сравните степень диссоциации этих электролитов. Сделайте вывод об их относительной силе.
- 2. В стаканчик с гидроксидом аммония добавьте фенолфталеин и прилейте уксусной кислоты до исчезновения малиновой окраски. Измерьте электропроводность полученного раствора. Напишите уравнение реакции. Сделайте вывод о силе полученного электролита.
- 3. Налейте 2 мл 1 н раствора соляной кислоты в пробирку и опустите в нее гранулу цинка. В другую пробирку налейте 1 н раствора уксусной кислоты и добавьте гранулу цинка. Напишите соответствующие уравнения реакций, объясните разницу в интенсивности протекания процессов.
Часть II. Дисперсные системы и коллоидные растворы
Цель работы: изучить методы получения коллоидных растворов и определения заряда коллоидных частиц.
Реактивы: 2%-ный раствор FeCl3, 0,1 М раствор K4[Fe (CN)6], дистиллированная вода, капельница с 2%-ным раствором канифоли в этиловом спирте, 50%-ный раствор Na2S203, капельница с концентрированной H2S04, крахмал.
Оборудование: электрическая плитка, мерные цилиндры на 100 мл, коническая колба на 250 мл с пробкой, химический стаканчик на 100 мл, стеклянная палочка, мерная пипетка на 1 мл, фильтровальная бумага, ступка и пестик, электронные весы.
Опыт 1. Получение гидрозоля канифоли методом конденсации.
Канифоль получают из смолы хвойных деревьев. В своем составе она содержит смоляные кислоты с большим количеством атомов углерода (например, C19H2gCOOH). Канифоль растворяется в спирте, образуя истинный раствор. В воде канифоль нерастворима. При добавлении воды к спиртовому раствору молекулы конденсируются в более крупные агрегаты. Таким образом, заменой растворителя можно получить коллоидный раствор.
Ход работы Отмерьте цилиндром 25 мл дистиллированной воды и перелейте ее в колбу. Добавьте, энергично встряхивая, по каплям 1—3 мл 2%-ного спиртового раствора канифоли. Образуется молочно-белый устойчивый золь.
Опыт 2. Получение гидрозоля серы окислительно-восстановительной реакцией.
Золь серы получают действием серной кислоты на раствор тиосульфата натрия:
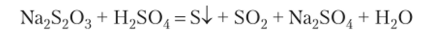
образуется золь серы: [nS • mS04~ • (т — х) Н+] • хН+.
Ход работы Налейте в колбу 10 мл 50%-ного раствора тиосульфата натрия. Добавьте по каплям, интенсивно перемешивая, концентрированный раствор серной кислоты до образования густой массы бледно-желтого цвета. Добавьте 25 мл дистиллированной воды и нагрейте, изредка помешивая, в течение 20 мин до образования молочно-белого золя серы.
Опыт 3. Получение золя гидроксида желаза (Ш) путем гидролиза.
Гидроксид железа (Ш) получают реакцией гидролиза:

Формирующиеся агрегаты Fe (OH)3 подтравливаются с поверхности соляной кислотой, образуя соединение состава FeOCl, которое при диссоциации дает ионы FeO+, близкие по природе составу ядра и поэтому адсорбирующиеся на нем:
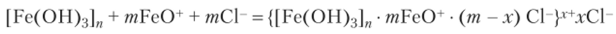
Отмерьте цилиндром 50 мл дистиллированной воды и перелейте ее в колбу. В дистиллированную воду по каплям добавьте 2—3 мл 2%-ного раствора FeCl3. Нагрейте полученный раствор на электрической плитке до образования коллоидного раствора гидроксида железа (Ш) интенсивно красно-коричневой окраски. Коллоидный раствор сохраните для опыта 6.
Опыт 4. Получение золя берлинской лазури реакцией обмена.
Гидрозоль берлинской лазури получают реакцией обмена:
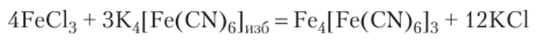
К 2 мл 0,1 М раствора K4[Fe (CN)6] добавьте 40 мл дистиллированной воды. В полученный раствор прилейте 0,5 мл 2%-ного раствора FeCl3. Напишите формулу мицеллы образовавшегося золя. Коллоидный раствор сохраните для опыта 6.
Опыт 5. Получение гидрофильного золя крахмала диспергированием.
Крахмал является высокомолекулярным веществом. Его молекулы взаимодействуют с водой, образуя гидрофильный золь, который является истинным молекулярным раствором. Макромолекулы крахмала имеют размер, соизмеримый с размером коллоидных частиц. Этим объясняется схожесть оптических свойств, скоростей диффузии, величин осмотических давлений растворов ВМС и коллоидных растворов.
Ход работы Навеску 0,5 г крахмала разотрите в ступке и поместите в химический стаканчик, добавьте 10 мл воды. Тщательно размешайте и добавьте еще 90 мл воды. Нагрейте на электрической плитке полученную смесь при постоянном перемешивании до кипения и получения опалесцирующего золя крахмала.
Опыт 6. Определение знака заряда коллоидных частиц.
Поверхность некоторых веществ при погружении в воду заряжается отрицательно. К таким веществам относятся шелк, стекло, песок, целлюлоза, из которой получают фильтровальную бумагу. Это явление используется для определения знака заряда коллоидных частиц. Если нанести каплю коллоидного раствора на фильтр, то отрицательно заряженные коллоидные частицы будут двигаться вслед за водой по капиллярам бумаги, поскольку не будут притягиваться волокнами целлюлозы. Положительно заряженные коллоидные частицы, взаимодействуя с целлюлозой, останутся в месте нанесения капли раствора.
Ход работы Нанесите пинеткой на фильтр 3—5 капель коллоидного раствора Ее (ОН)3. Капли нужно нанести в одну точку с интервалом в несколько секунд. Таким же образом нанесите на другой фильтр три капли коллоидного раствора берлинской лазури. Понаблюдайте за движением коллоидных частиц. Сделайте вывод о заряде коллоидных частиц каждого золя.
- [1] Как называется движение частиц дисперсной фазы к одномуиз электродов? 1) электрофорез; 2) электроосмос; 3) коагуляция.