Кинетика коагуляции.
Коллоидная химия

После прилипания частицы к другой, уже входящей в структуру агрегата, происходит жесткая фиксация частицы, то по мере увеличения размеров агрегатов плотность частиц в них падает. Это связано с тем, что в действительности взаимодействие частиц осуществляется не со всей поверхностью агрегата, как это заложено в рассмотренном выше выводе уравнения Смолуховского, а с уже включенными в его состав… Читать ещё >
Кинетика коагуляции. Коллоидная химия (реферат, курсовая, диплом, контрольная)
Задача о частоте столкновения частиц в тепловом движении и скорости коагуляции нестабилизированных коллоидных систем, когда каждая встреча частиц приводит к их объединению (процесс быстрой коагуляции), была решена М. Смолуховским применительно к монодисперсной в исходном состоянии системе. В разбавленной системе вероятность одновременного столкновения трех частиц мала, поэтому можно учитывать только соударения двух частиц, и описание коагуляции сведется к рассмотрению серии последовательных бимолекулярных реакций между двумя одиночными частицами, одиночной и двойной и т. д. Тогда частота столкновения т-мерной частицы (агрегата, содержащего т первичных частиц) с л-мерной частицей определяется их концентрациями пт и п": 
Константа скорости этого процесса слабо зависит от размеров частиц и при их близких размерах равна (см. петит далее):

где т| — вязкость дисперсионной среды.
При каждом столкновении два агрегата объединяются в один. Изменение суммарного числа агрегатов всех размеров (от т = 1 до т к 30) во времени описывается поэтому дифференциальным уравнением.
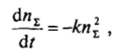
решение которого дает уравнение Смолуховского:
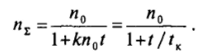
Здесь время коагуляции tK = 1 /кп0, представляющее собой время уменьшения числа агрегатов вдвое, определяется исходной концентрацией системы я0, вязкостью дисперсионной среды и температурой:

При медленной коагуляции число столкновений частиц, приводящих к их сцеплению, уменьшается вследствие существования энергетического барьера, препятствующего сближению частиц. Это можно учесть, вводя некоторый фактор замедления коагуляции W, равный отношению истинного значения константы коагуляции к величине, определяемой, по Смолуховскому, выражением (VII.29). Фактор замедления коагуляции зависит от высоты энергетического барьера итзх, а также от толщины ионной атмосферы 1/эе (см. петит далее). Уменьшение значения итах при введении электролитов вызывает снижение фактора замедления коагуляции, т. е. возрастание наблюдаемой скорости коагуляции вплоть до значений, предсказываемых теорией Смолуховского (или несколько больших из-за влияния сравнительно дальнодействующих сил притяжения между частицами).
Большое внимание исследователей в последние годы уделено компьютерному моделированию процессов агрегирования и анализу структуры возникающих агрегатов с позиции теории фракталов (фрактальной геометрии). Такие исследования показывают, что, если.
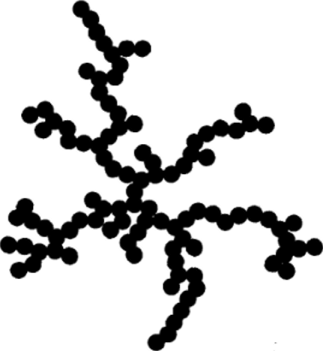
Рис. VII-13. Изображение двухмерного фрактального агрегата из 100 частиц: получено численным моделированием.
после прилипания частицы к другой, уже входящей в структуру агрегата, происходит жесткая фиксация частицы, то по мере увеличения размеров агрегатов плотность частиц в них падает. Это связано с тем, что в действительности взаимодействие частиц осуществляется не со всей поверхностью агрегата, как это заложено в рассмотренном выше выводе уравнения Смолуховского, а с уже включенными в его состав частицами. При этом вероятность прилипания к частицам, находящимся на поверхности агрегата, больше, чем к более глубоко расположенным центрам коагуляции. Это приводит к образованию цепочек частиц, которые «перекрывают» доступ новых броунирующих частиц к внутренним областям агрегата, так что там возникают лишь редкие разветвления. В результате этого среднее координационное число частиц в таких рыхлых агрегатах оказывается между 2 и 3, что уже отмечалось в VII. 1. Структуру агрегата из 100 частиц иллюстрирует рис. VII-13, полученный методом компьютерного моделирования двухмерной коагуляции[1].
Как показывает проведенное рассмотрение[2], общее число частиц в агрегате N связано с его радиусом инерции Rg скейлинговым соотношением вида.
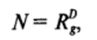
где D — показатель степени (является дробным числом и равен 1,72 при моделировании коагуляции в двухмерной системе и 2,5 при трехмерном моделировании). Заметим, что математические основы теории фракталов и теории перколяции (см. IV. 1) близки.
Если энергия контакта невелика, то связь между частицами в агрегате оказывается слабой, и наряду с коагуляцией происходит перестройка структуры агрегата с постепенным возрастанием координационного числа вплоть до значения 12, характерного для плотной упаковки одинаковых по размеру сферических частиц. Такая плотная упаковка характерна, например, при агрегировании обратных эмульсий, а в некоторых случаях и монодисперсных латексов. В результате подобных процессов агрегирования возникают упорядоченные структуры, которые в последние годы получили название «коллоидные кристаллы».
Наряду с рассмотренной выше перикинетической коагуляцией, когда слипание частиц происходит при их соударении в процессе броуновского движения, важное значение имеет и так называемая ортокинетическая коагуляция. При ортокинетической коагуляции соударение частиц является следствием их движения друг относительно друга при послойном течении жидкости или оседании частиц с различными скоростями. В последнем случае (при седиментации) крупные частицы, движущиеся с более высокой скоростью, могут догонять медленно оседающие частицы и захватывать их. Вероятность такого сцепления крупных и мелких частиц зависит от соотношения скоростей их оседания, а также от условий прилипания малых частиц к поверхности более крупных.
Ортокинетическая коагуляция имеет существенное значение для таких важных в практическом отношении процессов, как флотация, водоочистка, пенная очистка, улавливание пыли, а также при естественном и искусственном образовании осадков из туч.
Рассмотрим более подробно теорию коагуляции Смолуховского.
В соответствии с теорией случайных процессов при броуновском движении двух частиц можно одну частицу рассматривать как неподвижную, т. е. связать начало координат с данной, скажем, л-мерной частицей, считая при этом, что вторая частица имеет коэффициент диффузии, равный сумме коэффициентов диффузии частиц: = Da+ Dt. При сближении частиц на расстояние /?", равное сумме радиусов т-мерной и л-мерной частиц, происходит их коагуляция, т. е. они переходят в новое (т + л)-мерное состояние. Поэтому следует считать, что концентрация л"-мерных частиц на расстоянии Rт от центра л-мерной частицы равна нулю. При таких краевых условиях и в предположении сферической формы частиц выражение (IV.20) может быть записано в виде.
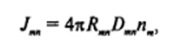
где Jm — поток диффузии /n-мерных частиц к рассматриваемой л-мерной.
Умножая полученное выражение на концентрацию «центральных* л-мсрных частиц в сопоставлении с (VII.29), имеем.
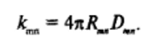
По уравнению Эйнштейна (V. 11) коэффициент диффузии D связан с радиусом диффундирующей частицы г соотношением.
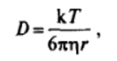
где т] — вязкость дисперсионной среды. Следовательно,.
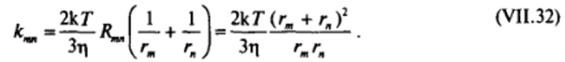
Из рис. VII-14, на котором приведен график зависимости величины 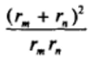 от соотношения радиусов rJrM диффундирующих частиц, видно, что вблизи минимума (в области значений rJrH ^ 3) кривая имеет участок, на котором величина.
от соотношения радиусов rJrM диффундирующих частиц, видно, что вблизи минимума (в области значений rJrH ^ 3) кривая имеет участок, на котором величина.
^ * г" ^ *4 и приблизительно постоянна. Число исходных частиц радиусом г, в агре;
гате размером гт пропорционально (rjr) Следовательно, значениям rjr" - 3 соответствует примерно тридцатикратное увеличение объемов агрегатов по сравнению с исходными частицами, т. е. достаточно глубокая стадия коагуляции. В соответствии с выражением (VII.32) в области постоянства отношения 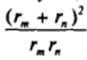 константа слабо зависит от размера сталкивающихся частиц:
константа слабо зависит от размера сталкивающихся частиц:
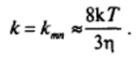
Изменение во времени концентрации /л-мерных частиц зависит от суммы скоростей появления таких частиц из всех возможных парных комбинаций частиц меньшего размера за вычетом скорости исчезновения таких частиц при столкновении с различными другими частицами: 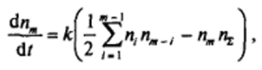
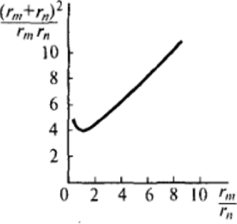
Рис. VII-14. Графический вид зависимости (г. + 07V* отношения rjru
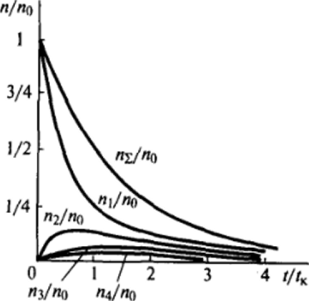
Рис. VII-15. Зависимости от времени приведенной концентрации единичных частиц л" небольших агрегатов (т * 2 + 4) и суммарного числа агрегатов /ц где коэффициент '/, учитывает, что каждое столкновение рассматривается дважды. Последовательное решение этих уравнений для единичных, двойных, тройных и т. д. частиц дает совокупность уравнений вида:
На рис. VII-15 приведены зависимости от времени величин  и приведенных концентраций некоторых небольших агрегатов (т = 2 + 4).
и приведенных концентраций некоторых небольших агрегатов (т = 2 + 4).
Миллером был рассмотрен случай коагуляции системы, в которой находятся частицы двух сильно различающихся размеров. Этому случаю на рис. VII-14 отвечает восходящая ветвь кривой зависимости 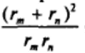 отrjrat где величина
отrjrat где величина 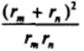 непостоянна и быстро возрастает при изменении отношения rjr,. В соответствии с выражениями (VII.3I) и (VII.32) здесь обнаруживается резкое увеличение скорости коагуляции.
непостоянна и быстро возрастает при изменении отношения rjr,. В соответствии с выражениями (VII.3I) и (VII.32) здесь обнаруживается резкое увеличение скорости коагуляции.
Если частицы взаимодействуют друг с другом на расстояниях, превышающих их удвоенный радиус, то это влияет на скорость коагуляции. Н. А. Фукс (1934) показал, что в этом случае надо рассматривать диффузию частиц радиусом г в пате их взаимодействия, описываемого функцией u®.
Уравнение Фика принимает при этом следующий вид:
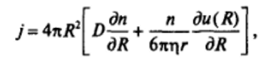
а фактор замедления коагуляции определяется выражением 
Истинные значения константы скорости коагуляции оказываются в И^раз ниже значения, даваемого выражением (VI1.30):
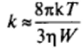
Соответственно, время коагуляции оказывается в И’раз больше, чем при быстрой коагуляции. Из-за сложного вида функции и (R) решение уравнения (VII.33) требует численного интегрирования. Для качественного рассмотрения часто полагают, что фактор замедления коагуляции приближенно равен:
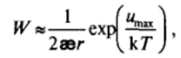
т. е. определяется высотой потенциального барьера и отношением толщины диффузной части двойного электрического слоя 1/аэ к радиусу частиц г.
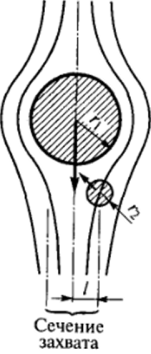
Рис. VII-16. Схема, иллюстрирующая сближение частиц под действием инерционных сил
При ортокинетической коагуляции оседающая крупная частица способна захватить более мелкие, центры которых находятся в некотором вертикальном цилиндре с осью, проходящей через центр более крупной частицы; основание этого цилиндра называется сечением захвата. Поскольку дисперсионная среда вместе с находящимися в ней малыми частицами обтекает оседающую крупную частицу, радиус сечения захвата меньше суммы радиусов большей и малой частиц и зависит от условий приближения малой частицы к поверхности крупной. Самые малые частицы диффундируют к поверхности более крупной частицы в ходе обтекания се жидкостью, причем диффузия ускоряется под действием молекулярных сил притяжения.
На частицы размером, приближающимся к размерам крупной частицы, основное воздействие оказывают инерционные силы, возникающие в начале обтекания, когда движение жидкости направлено в сторону от оси оседания крупной частицы (рис. VII-16). Сближение частиц обусловлено действием этих инерционных сил, и лишь при малых расстояниях становятся существенными молекулярные силы, которые и вызывают их слипание. Проведенное С. С. Духиным теоретическое рассмотрение, так же как и результаты экспериментальных исследований, показывает, что при оседании очень крупных частиц наиболее эффективно захватываются частицы, близкие по размеру, для которых велики инерционные силы, а также очень мелкие (быстро диффундирующие); частицы же промежуточных размеров захватываются хуже, так как для них сравнительно малы и инерционные силы, и скорость диффузии.
- [1] Компьютерное моделирование осуществлялось следующим образом. Фиксировалась центральная частица и затем случайным образом поочередно вбрасывались последующие частицы на окружность радиусом, в несколько раз превышающим радиусконечного агрегата. После этого задавались случайные смешения частицы и на каждомцикле проверялось ее расстояние до всех частиц, уже вошедших в агрегат; если расстояние до какой-либо частицы оказывалось меньшим или равным удвоенному радиусучастицы, она считалась вошедшей в агрегат и вбрасывалась следующая частица. Дляпредотвращения ухода частиц из поля экрана снаружи была введена «отражающаястенка*.
- [2] См., например, Р. Meakin, in On Growth and Form. Fractal and Non-FractalPatterns in Physics. Martinus Nijhoff pbl., 1986, p. Ill — 135.