Механизм окислительно-восстановительной реакции

Окислительно-восстановительные реакции играют огромную роль в природных процессах. Два планетных процесса — фотосинтез и перенос кислорода и углекислого газа кровыо — состоят из множества окислительно-восстановительных реакций, изучение которых продолжается. Уравнения окислительно-восстановительных реакций нс дают представления о механизме реакции и ее стадиях. Даже уравнение реакции обмена… Читать ещё >
Механизм окислительно-восстановительной реакции (реферат, курсовая, диплом, контрольная)
Окислительно-восстановительные реакции проходят по очень сложному пути. Ведь любая окислительно-восстановительная реакция — это две сопряженные реакции приема и отдачи электронов, и эти реакции проходят одновременно. Каждая реакция окисления и восстановления в свою очередь состоит из многих последовательно-параллельных реакций, сложность механизма которых можно понять, хотя бы исходя из того, что в каждой элементарной (простейшей) стадии должен участвовать всего один электрон.
Уравнения окислительно-восстановительных реакций нс дают представления о механизме реакции и ее стадиях. Даже уравнение реакции обмена электронами не отвечает действительному пути  реакции, протекающей по достаточно сложному пути.
реакции, протекающей по достаточно сложному пути.
Сближение двух положительно заряженных ионов затруднено из-за их взаимного отталкивания.
Введение
в раствор отрицательно заряженных ионов А" значительно ускоряет реакцию, благодаря тому что ионы, А образуют неустойчивые соединения с ионами железа, а это ослабляет силы межионного отталкивания.
Возможно, реакция 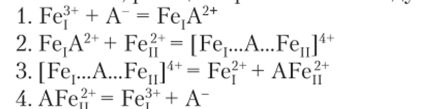 протекает по следующим стадиям:
протекает по следующим стадиям:
Образующийся по первой стадии ион Fe, A2+ имеет меньший по сравнению с исходным ионом Fef+ заряд, поэтому столкновение ионов FejA2+ и FeI2I+ с большей вероятностью должно привеси к их взаимодействию и образованию трехатомного иона [Fe,…A…Fen]4+. В этом ионе электрон переходит от Fe" к, А и далее к Fe,.
В результате трехатомный ион распадается на Fe2+ и AFe,2+. Последний распадается на ионы Fef,4 и исходный ион, А. В этой реакции анион А~ играет роль катализатора. Важно, чтобы связь аниона, А с катионом железа была не слишком прочной, иначе скорость распада комплекса |FeI…A…FeII] может оказаться низкой и добавление аниона не приведет к ускорению реакции, а, наоборот, замедлит ее.
Оказалось, что в изопропиловом спирте скорость обмена электронами между Fe2+n Fe3+ в 108 раз (!) ниже, чем в воде. Это говорит об участии в реакции молекул воды. Более того, скорость обмена электронами в тяжелой воде D20 в два раза ниже, чем в обычной, что указывает на участие атомов водорода в реакции.
На основании этих данных было выдвинуто предположение, что обмен электронов совершается переносом протона через молекулу воды:
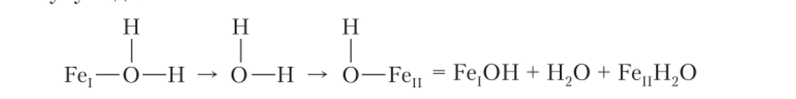
Возможны и другие механизмы этой, казалось бы, простой реакции.
Трудность описания механизма окислительно-восстановительных реакций связана с тем, что путь превращения какого-либо вещества зависит от природы другого участника реакции, на путь превращения которого в свою очередь оказывают влияние особенности первого вещества. Такое взаимовлияние веществ системы присуще всей природе.
Окислительно-восстановительные реакции играют огромную роль в природных процессах. Два планетных процесса — фотосинтез и перенос кислорода и углекислого газа кровыо — состоят из множества окислительно-восстановительных реакций, изучение которых продолжается.