Окислительно-восстановительные (red/ox) реакции

В качестве переносчиков электронов в дыхательную цепь митохондрий входят различные белки, содержащие разнообразные функциональные группы, которые предназначены для переноса электронов. По мере продвижения по цепи от одного интермедиата к другому электроны теряют свободную энергию. На каждую пару электронов, переданных по дыхательной цепи кислороду, синтезируются три молекулы АТФ. Свободная… Читать ещё >
Окислительно-восстановительные (red/ox) реакции (реферат, курсовая, диплом, контрольная)
Окислительно-восстановительными реакциями называют химические процессы, сопровождающиеся переносом электронов от одних молекул или ионов к другим.
Например, при вытеснении меди из раствора C11SO4 цинком Zn 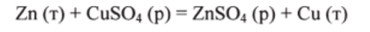 электроны от атомов цинка переходят к ионам меди:
электроны от атомов цинка переходят к ионам меди:
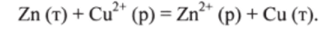
При окислительно-восстановительных реакциях протекают два взаимосвязанных процесса: окисление и восстановление.
-^-Окислением называется процесс потери электронов, восстановлением называется процесс присоединения электронов.
Вещества, атомы или ионы которых отдают электроны, называют восстановителями (Red) (от лат. «reductio» — возвращение). Вещества, атомы или ионы которых присоединяют электроны (или оттягивают к себе общую пару электронов), называют окислителями (Ох) (от греч. «oxys» — кислый).
В реакции цинка с CuS04 ионы Си2+ присоединяют электроны:
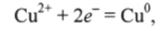
атомы цинка отдают электроны:
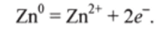
Соответственно CuS04 — окислитель, Zn — восстановитель.
Важными процессами в жизнедеятельности организма являются ферментативные окислительно-восстановительные реакции расщепления пищевых веществ — субстратов: углеводов, жиров, аминокислот. В результате этих реакций организм получает большое количество энергии. Приблизительно 90% всей потребности взрослого мужчины в энергии покрывается за счет энергии, вырабатываемой в тканях при окислении углеводов и жиров. Остальную часть энергии (~10%) дает окислительное расщепление аминокислот.
Биологическое окисление протекает по сложным механизмам при участии большого числа ферментов (см. биоокисление глюкозы, разд. 9.4). В митохондриях окисление происходит в результате переноса 2 электронов е от органических субстратов — интермедиатов — на элементный кислород 62, который при этом восстанавливается до воды: 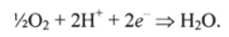
В качестве переносчиков электронов в дыхательную цепь митохондрий входят различные белки, содержащие разнообразные функциональные группы, которые предназначены для переноса электронов. По мере продвижения по цепи от одного интермедиата к другому электроны теряют свободную энергию. На каждую пару электронов, переданных по дыхательной цепи кислороду, синтезируются три молекулы АТФ. Свободная энергия, выделяющаяся при переносе двух электронов на кислород, составляет 220 кДж/моль.
На синтез одной молекулы АТФ в стандартных условиях расходуется 30,5 кДж. Отсюда ясно, что довольно значительная часть свободной энергии, выделяющейся при переносе одной пары электронов, запасается в молекулах АТФ. Из этих данных становится понятной и роль многостадийной передачи электронов от исходного восстановителя к кислороду. Большая энергия (220 кДж), выделяемая при переносе одной пары электронов к кислороду, разбивается на ряд порций, соответствующих отдельным стадиям окисления. На трех таких стадиях количество выделяющейся энергии примерно соответствует энергии, необходимой для синтеза одной молекулы АТФ.
Окислительно-восстановительные реакции лежат в основе методов оксидиметрии, которые применяют в клинических, а также в санитарно-гигиенических анализах. Эти методы используют для определения в крови ионов кальция, мочевой кислоты, ферментов — каталазы и пероксидазы, глюкозы. В санитарногигиенических целях определяют окисляемость воды, содержание «активного» хлора в хлорной извести, остаточный хлор в хозяйственно-питьевой воде.