Курсовая работа «Экспериментальное определение констант ионизации слабых кислот и оснований»

Этот метод приближенный, в нем не учитываются реакция автопротолиза воды, а также значения средних ионных коэффициентов активности. Как показывают расчеты, такое допущение возможно, если исследовать кислоты, константы ионизации которых лежат в диапазоне 1 * 10 4 — 1 • 10 6 (= 1 моль/л). Поскольку кислота слабая, то можно предположить, что концентрация ионов гидроксония гораздо меньше, чем… Читать ещё >
Курсовая работа «Экспериментальное определение констант ионизации слабых кислот и оснований» (реферат, курсовая, диплом, контрольная)
Экспериментальные курсовые работы требуют от студентов не только знания материала, но и умения самостоятельно проводить опыты, анализировать результаты и делать обобщающие выводы. В рамках предлагаемой курсовой работы студенту предстоит познакомиться с двумя (или тремя) различными методами определения важнейших физико-химических констант.
Определение констант ионизации слабых электролитов методом рН-метрии
В этом методе можно использовать различные индикаторные электроды: хингидронный, стеклянный, водородный. Чаще всего такое определение проводят со стеклянным индикаторным электродом и хлорсеребряным электродом сравнения, работая на специальном приборе — pH-метре. В этом приборе измеренная компенсационным методом ЭДС электрохимической цепи преобразуется в показания шкалы pH.
Рассмотрим ионизацию слабой одноосновной кислоты, протекающую по уравнениям.

Балансовые уравнения имеют вид.

Константа ионизации слабой кислоты находится по уравнению.

Этот метод приближенный, в нем не учитываются реакция автопротолиза воды, а также значения средних ионных коэффициентов активности. Как показывают расчеты, такое допущение возможно, если исследовать кислоты, константы ионизации которых лежат в диапазоне 1 * 10 4 — 1 • 10 6 ([с] = 1 моль/л).
Тогда уравнение (1.35) можно представить как.
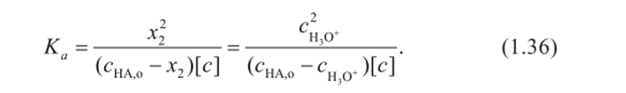
Поскольку кислота слабая, то можно предположить, что концентрация ионов гидроксония гораздо меньше, чем аналитическая концентрация слабой кислоты сц 0+ <$: сНАо, тогда уравнение (1.36) преобразуется к виду.

Прологарифмировав уравнение (1.37) и выразив величины, в него входящие, как функцию pH раствора, получим.
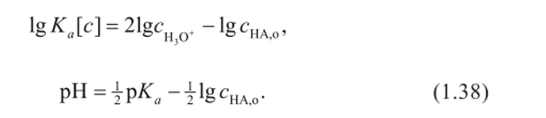
Уравнение (1.38) линейно в координатах pH — логарифм концентрации кислоты. Свободный член этого уравнения связан с константой ионизации. При экспериментальном определении величины константы ионизации методом pH-метрии необходимо представить экспериментальные данные в виде графической зависимости pH = /(lgcHAo) и по отрезку, отсекаемому на оси ординат, определить величину константы ионизации (рис. 1.9).
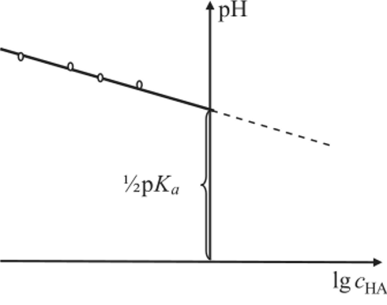
Рис. 1.9.
Ионизация слабого основания может быть выражена уравнением

Рассуждая аналогично примеру со слабой кислотой, получим для слабого основания зависимость величины pH от логарифма концентрации электролита.
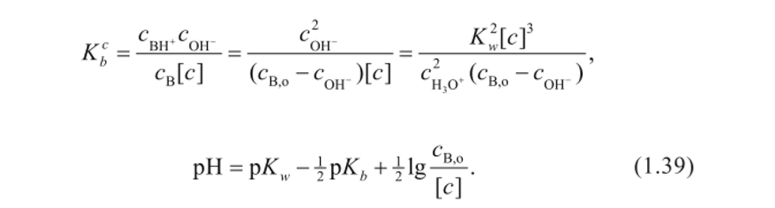
Графическое построение этой зависимости (1.39) позволит определить величину константы ионизации слабого основания (рис. 1.10).
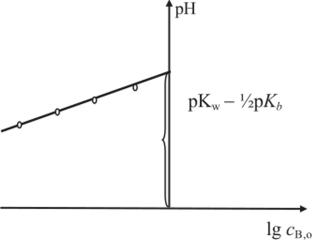
Рис. 1.10.