Непредельные углеводороды.
Химия

Увеличение электронной плотности на связи С=С приводит к некоторому ее уменьшению на связи С—Н, на водороде возникает положительный заряд, связь поляризуется, и в результате ацетилен обладает некоторыми кислотными свойствами, в частности образует соединения с металлами — ацетилениды. Например, при 150 °C ацетилен непосредственно реагирует с натрием, образуя ацетиленид натрия: За счет разрыва этих… Читать ещё >
Непредельные углеводороды. Химия (реферат, курсовая, диплом, контрольная)
Непредельные углеводороды делятся на алкены, диены и алкины. В непредельных углеводородах имеются атомы углерода в состоянии sp2- или sp-гибридизации. Электроны, не участвующие в гибридизации, взаимодействуя между собой, увеличивают порядок связи между атомами углерода до двух (С=С) или до трех (С=С), образуя дополнительные тг-связи.
За счет разрыва этих связей молекулы непредельных углеводородов могут соединяться между собой или присоединять дополнительно какие-либо частицы, в частности атомы водорода, переходя в алканы. Многие из этих веществ используются в промышленности как сырье для получения синтетических органических соединений: спиртов, кислот, каучука и других полимерных материалов, и др.
Алкены. Углеводороды, имеющие в цепи одну связь С=С, называются алкенамиу их общая формула СГ1Н2п. По международной номенклатуре названия алкенов производятся от названий алканов заменой окончания -ан на -еНу но для первых членов ряда часто используются тривиальные названия — этилен, пропилен, бутилен.
Простейшим представителем алкенов является этен — С2Н4 или Н2С=СН2. При написании формул углеводородов радикалы обычно записывают, начиная с углерода: СН7=СН2. Пропен имеет формулу СН2=СН-СН3, и у него, как и у пропана, один изомер. Ноу бутена не два изомера, как у бутана, а четыре. Два из них различаются положением двойной связи, которое указывается цифрой:
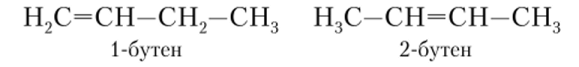
Цифра показывает положение в цепи первого из кратно связанных атомов углерода. Третий изомер возникает из-за разветвления цепи, это метилпропен:
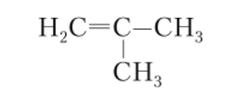
Появление четвертого изомера связано с возникновением нового типа изомерии, обусловленного свойствами кратно связанных атомов углерода: 5р2-гибридные орбитали образуют плоскую треугольную систему, причем л-связь может существовать только тогда, когда оба треугольника расположены в одной плоскости. В результате вся группа связей ^С=С^ оказывается жесткой плоской системой. Именно поэтому для 2-бутена могут существовать два изомера, различающиеся взаимным расположением заместителей на плоскости:
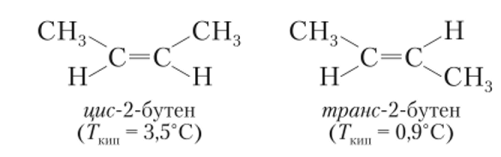
Поскольку вращение фрагментов друг относительно друга вокруг двойной связи невозможно, изомеры существуют как самостоятельные соединения.
По физическим свойствам алкены и алканы достаточно близки, но их химические свойства различаются очень сильно, что связано с меньшей прочностью л-связи (233 кДж/моль) атомов углерода, но сравнению с ст-связью (365 кДж/моль). Разрыв л-связи происходит относительно легко, и алкены значительно более реакционноспособны, чем алканы, причем наиболее характерны для них реакции присоединения, важнейшие из которых следующие.
Гидрирование. В присутствии катализаторов (металлы платиновой группы) алкены легко присоединяют водород, переходя в алканы (см. параграф 29.4). Например:
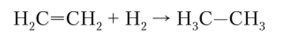
Галогенирование. Алкены легко реагируют с галогенами. В смеси со фтором они воспламеняются, с хлором и бромом реакция идет быстро и спокойно, с иодом — медленно на прямом солнечном свету. При пропускании алкена через бромную воду она обесцвечивается, например, в случае пропена за счет реакции, в ходе которой расходуется бром, а из пропена образуется 1,2-дибромпропан:
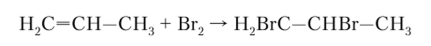
Очевидно, что при бромировании алкена бром (как и любой другой галоген) будет присоединяться к соседним атомам углерода, образуя дибромиды (в общем случае — дигалогениды).
Гидрогалогенирование. Алкены легко реагируют не только с галогенами, но и с галогеноводородами, причем наиболее легко реагирует иодоводород. Присоединение галогеноводородов к несимметричным алкенам происходит обычно в соответствии с правилом Марковникова: водород присоединяется к наиболее гидрогенезированному атому углерода. Например, при реакции пропена с хлороводородом образуется почти исключительно 2-хлорпропан: 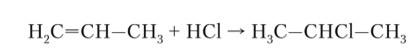
Алкены легко окисляются водным раствором КМп04, который при этом обесцвечивается, что служит качественной реакцией на непредельные углеводороды.
Важным свойством алкенов является способность их молекул реагировать друг с другом, образуя полимерные структуры (см. параграф 35.1).
Диены. Углеводороды, в молекулах которых имеется две двойных связи, называются диенами. Двойные связи могут примыкать к одному углеродному атому: Н., С=С=СН2 — пропадиен и его производные, к соседним атомам: Н2С=СН—СН=СН2 — 1,3-бутадиен и его производные, или могут быть разделены произвольным числом СН2-груип.
Наиболее интересные свойства и большое практическое значение имеют углеводороды с сопряженными — чередующимися — двойными связями — производные 1,3-бутадиена, который в промышленности иногда называют дивинилом.
В 1,3-бутадиене все четыре атома углерода находятся в состоянии .^-гибридизации, и несмотря на формальную разницу в обозначении связей: С=С—С=С, в действительности в молекуле образуется единая система л-связей и все три связи почти одинаковы. Эта особенность строения диенов приводит к тому, что они способны присоединять различные вещества не только по одной из двойных связей — в 1,2-положение, но и к крайним атомам сопряженной системы — в 1,4-положение. Двойная связь при этом перемещается в середину сопряженной системы:
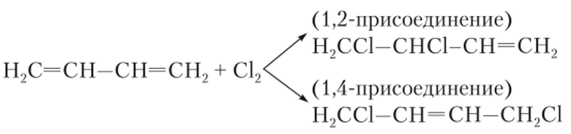
Практически важной является реакция полимеризации 1,3-бутадиена и его гомолога 2-метил-1,3-бутадиена (техническое название — изопрен), при которой взаимодействие молекул идет по типу 1,4-присоединения. Продуктами такой полимеризации являются искусственные каучуки (см. параграф 35.1).
Алкины. Углеводороды, имеющие в цепи одну связь С=С, называются алкины, их общая формула C,;H2w_2. В этих углеводородах два атома углерода, соединенные тройной связью, находятся в состоянии sp-гибридизации. Названия алкинов производят от названий алканов заменой окончания -ап на -ии, хотя первый член ряда СН=СН обычно называют не этин, а ацетилен, и остальные углеводороды рассматривают как замещенные ацетилены. Так, пропин СН=С—СН3 называют метилацетилен, а 2-пентин — СН3—С=С—СН2—СН3 — метилэтилацетилен.
Химические свойства алкинов подобны свойствам алкенов, но реакции с ними протекают, как правило, медленнее, чем с алкенами. Алкины присоединяют галогены и галогеноводороды, гидрируются до алкенов и алканов, окисляются бромной водой или раствором перманганата калия.
Увеличение электронной плотности на связи С=С приводит к некоторому ее уменьшению на связи С—Н, на водороде возникает положительный заряд, связь поляризуется, и в результате ацетилен обладает некоторыми кислотными свойствами, в частности образует соединения с металлами — ацетилениды. Например, при 150 °C ацетилен непосредственно реагирует с натрием, образуя ацетиленид натрия:
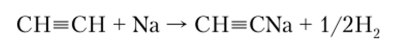
Ацетилениды тяжелых металлов (серебра, меди) чрезвычайно взрывчаты, а ацетиленид кальция (карбид кальция) производится в промышленных масштабах по реакции.
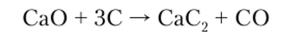
и применяется для получения ацетилена:
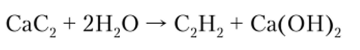
На воздухе ацетилен горит сильно коптящим пламенем, так как часть углерода не успевает окислиться. В смеси с кислородом происходит полное окисление, сопровождающееся большим выделением теплоты:
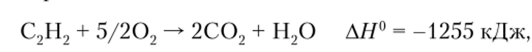
поэтому температура ацетилено-кислородного пламени превышает 3000 °C. Такое пламя, получаемое в специальных горелках, широко используется для резки и сварки металлов.