Функции белков и веществ пептидной природы

Е— энергия; Т— время; Ек — энергетический барьер реакции; Р — продукт реакции; 1 — реакция без катализатора; 2 — реакции, идущие при участии фермента ции. Химическая структура активного центра ферментов, как правило, отличается выраженной эволюционной консервативностью (например, набор аминокислотных остатков, входящих в состав активного центра трипсина, один и тот же у всех представителей в ряду… Читать ещё >
Функции белков и веществ пептидной природы (реферат, курсовая, диплом, контрольная)
Белки осуществляют следующие функции:
- 1) каталитическую, или ферментную (в связи с важной ролью белков-ферментов в обеспечении жизнедеятельности клетки и се функциональной активности рассмотрена отдельно, см. далее);
- 2) структурную (тубулин — белок микротрубочек цитоскелета; кератин — обеспечивает прочность волос и других производных кожи);
- 3) сократительную (актин и миозин — белки, обеспечивающие сократительные функции всех видов мышц);
- 4) транспортную; реализуется на различных уровнях организации организма: на клеточном (белки — переносчики аминокислот в составе плазматической мембраны), на уровне целого организма (сывороточный альбумин — белок, осуществляющий транспорт метаболитов, токсинов, лекарственных веществ);
- 5) защитную; с определенной долей условности данную функцию белков можно подразделить на биологическую защиту (гамма-глобулины, выполняющие функцию антител, дефензины — антимикробные пептидные факторы иммунокомпетентных клеток, интерфероны — противовирусные пептиды) и химическую (связывание токсинов некоторыми белками приводит к их нейтрализации, печеночные ферменты расщепляют яды или переводят их в растворимую форму, что способствует их быстрому выведению из организма);
- 6) рецепторную (мембранные, цитоплазматические и ядерные рецепторы для гормонов в клетках органов-мишеней, а также для вирусов);
- 7) регуляторную (пептидные гормоны — инсулин, гормон роста и др.; биологически активные вещества — производные аминокислот — тироксин, серотонин, мелатонин, адреналин, норадреналин; белковые факторы-регуляторы транскрипции и трансляции). Особым аспектом регуляторной функции пептидов является их сигнальная роль — способность служить сигнальными веществами, передающими сигналы между тканями, клетками или организмами. Типичным примером сигнальных пептидов являются цитокины — информационные молекулы, обеспечивающие взаимодействия между клетками. Исключительно велико значение цитокинов как фактора интеграции иммунной, эндокринной и нервной систем;
- 8) трофическую (белок эндосперма семян, ихтулин рыбьей икры используются зародышем в качестве питательного материала);
- 9) энергетическую — при окислении 1 г белка освобождается 17,6 кДж энергии;
- 10) некоторые специальные функции: являются участниками фотохимических реакций, лежащих в основе зрения, — зрительные пигменты родопсин и иодопсин и вспомогательные белки — трансдуцин и др.; выступают в роли ядов — яд змей, лягушек; участвуют в формировании запаса связанной воды в тканях — протсогликаны; способны придавать поверхности тех или иных биоструктур (клеточной стенке и др.) гидрофильные или гидрофобные свойства (гидрофобииы грибов); выполняют гомеостатическую функцию, например, дипептид аланил-гистидин (карнозин) в возбудимых тканях (мышечной, нервной) обеспечивает постоянство pH, трипептид глютатион выполняет функцию протектора белков (предохраняет от окисления свободные SI 1-группы), тетрапептид тафцин принимает участие в регуляции иммунитета, белковые буферные системы крови поддерживают ее кислотно-щелочное равновесие.
Следует отметить, что классификация белков, но их функциям достаточно условна, потому что один и тот же белок может выполнять несколько функций. Приведем несколько примеров. Ферменты аминоацил-тРНК-синтетазы, осуществляющие присоединение активированной аминокислоты к тРПК, также принимают участие в регуляции транскрипции определенных генов и трансляции. Особый вид белков-антител — абзимы — обладают каталитической активностью (способны расщеплять пептиды и нуклеиновые кислоты). Белок Ku-антиген, встречающийся в ядре, цитоплазме и в составе плазмалеммы, выполняет не менее трех функций: является одним из главных «действующих лиц» системы репарации двухцепочечных разрывов ДНК, принимает участие в регуляции апоптоза, обеспечивает (в совокупности с другими поверхностными белками) специфическую межклеточную адгезию. Многие функции белки выполняют благодаря своей ферментативной активности. Так, ферментами являются двигательный белок миозин, регуляторные белки нротеинкиназы, транспортный белок натрийкалиевая аденозинтрифосфатаза и др.
Рассмотрим подробно каталитическую (ферментную) функцию белков.
Современная теория ферментного катализа носит название «теория фермент-субстратных комплексов» или «теория стабилизации переходного состояния».
Рабочий цикл фермента:
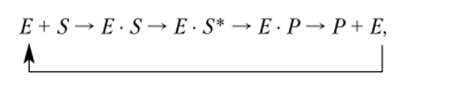
где Е — фермент; S — субстрат; Е S — фермент-субстратный комплекс; Е • S* — активированное состояние субстрата в составе фермент-субстратного комплекса; ЕР— комплекс «фермент — продукт»; Р — продукт реакции.
Фермент «выходит» из реакции в неизмененном виде и вновь может участвовать в аналогичном процессе. Число рабочих циклов зависит от скорости химической модификации молекулы фермента, приводящей к утрате его каталитической активности. С этих позиций все ферменты принято делить на быстрые (например, для каталазы число рабочих циклов составляет 9 Ю4 в 1 с), средние (например, для сукцинатдегидрогеназы — 184 цикла в 1 с) и медленные (например, для трипсина — 22 цикла в 1 с).
Большинство ферментов характеризуется высокой субстратной специфичностью, т. е. способны взаимодействовать только с одним или несколькими близкими по своей химической структуре субстратами.
Механизм ферментативного катализа заключается в том, что фермент, соединяясь с субстратом (временной ковалентной связью), осуществляет другую реакцию (реакции) с более низким энергетическим потенциалом по сравнению с реакцией, идущей без участия катализатора (рис. 3.53).
Преобразование субстрата происходит в специальной области молекулы белка-фермента — активном центре. Размеры активного центра невелики, в его образовании принимают участие 4—10 аминокислотных остатков, остальная часть молекулы (вся или почти вся) необходима для поддержания его пространственной организа;

Рис. 3.53. Кинетика ферментативного катализа:
Е— энергия; Т— время; Ек — энергетический барьер реакции; Р — продукт реакции; 1 — реакция без катализатора; 2 — реакции, идущие при участии фермента ции. Химическая структура активного центра ферментов, как правило, отличается выраженной эволюционной консервативностью (например, набор аминокислотных остатков, входящих в состав активного центра трипсина, один и тот же у всех представителей в ряду позвоночных). Важное значение для поддержания его пространственной организации имеют ионы металлов (Mg, Fe, Си, Мо и др.). В ряде случаев они непосредственно участвуют в процессах катализа. Существенно, что активный центр не является предсуществующим структурным элементом молекулы фермента, а формируется в процессе его взаимодействия с молекулой субстрата в результате специфических конформационных преобразований, индуцируемых последним. При этом наибольшему сближению реагирующих группировок фермента и субстрата способствует электрическое поле, поддерживающееся в очень малом объеме в безводной среде, то есть при низкой диэлектрической проницаемости (отметим, что область активного центра большинства ферментов характеризуется гидрофобностыо). Кроме того, боковые радикалы аминокислотных остатков, расположенных вблизи активного центра, могут формировать с молекулой субстрата временные связи, что значительно ускоряет течение процесса. У некоторых сложноорганизованных ферментов имеется несколько различных активных центров, благодаря чему они способны последовательно катализировать цепь «жестко» связанных реакций метаболизма, например биосинтез жирных кислот (фермент синтетаза жирных кислот содержит шесть активных центров).
Наряду с активным центром в молекуле ряда ферментов имеются аллостерический центр (у некоторых сложных ферментов, например ферментов цикла Кребса, — несколько) — для взаимодействия с регуляторными агентами — эффекторами (гормонами, метаболитами и др.) и аллотопический центр — для прикрепления к мембранным структурам (рис. 3.54).
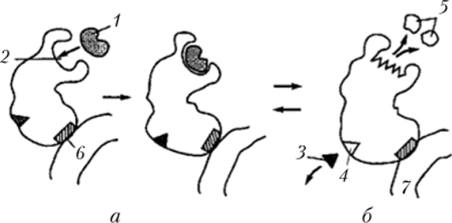
Рис. 3.54. Схема функционирования фермента:
а — активные состояния фермента; б — неактивное состояние фермента; 1 — субстрат; 2 — активный центр фермента; 3 — регуляторный агент (гормон, метаболит и др.); 4 — аллостерический центр; 5 — продукт (продукты); 6 — аллотопический центр; 7 — биоструктура (мембрана и др.).
Ферменты могут функционировать в свободном состоянии, в составе многоферментных комплексов, а также будучи встроенными в структуру мембран и других образований (рибосом, клеточного центра и др.).
Особого внимания заслуживает способность ферментов, катализирующих определенные цепи реакций, формировать надмолекулярные ансамбли — многоферментные комплексы. При этом их взаимная топография в этих комплексах организуется, но эстафетному принципу — ферменты, осуществляющие катализ смежных (сопряженных) реакций, оказываются расположенными в непосредственной близости. Наряду с каталитическими субъединицами в состав метаболона могут входить регуляторные субъединицы, служащие для взаимодействия с молекулами-эффекторами. Необходимо особо отметить, что в пределах многоферментного агрегата каталитические и регуляторные субъединицы могут оказывать друг на друга определенные влияния, благодаря чему функционирование элементов системы приобретает координированный характер и эффективность ее работы в целом существенно повышается. Примером многоферментного комплекса может служить метаболой цикла трикарбоновых кислот (цикл Кребса).
Активность ферментов в значительной степени зависит от условий среды. Для каждого фермента существует своя зона оптимального pH, температуры, давления, концентрации определенных ионов и др.