Сенсибилизированные (активированные) электроды

Внешний вид одного из pH-метров показан на рис. 4.21. Он представляет собой многопараметрический микропроцессорный анализатор жидкости, предназначенный для измерения показателя активности pH (-1 — 14), рХ (-20…20), массовой С (0,01 — 10 000 мг/дм3) или молярной Ст (103—104) концентрации ионов, окислительно-восстановительного потенциала Eh (-3200—3200 мВ), температуры Т (-5…150°С) и концентрации… Читать ещё >
Сенсибилизированные (активированные) электроды (реферат, курсовая, диплом, контрольная)
Газочувствительные электроды — это датчики, объединяющие индикаторный электрод и электрод сравнения и имеющие газопроницаемую мембрану или воздушный зазор для отделения анализируемого раствора от тонкой пленки промежуточного раствора электролита. Он взаимодействует с определяемым газом, при этом изменяется какой-то параметр промежуточного раствора, например pH, что и фиксирует ионоселективный электрод.
Отклик ионоселективного электрода пропорционален парциальному давлению определяемого компонента в анализируемом газе. Схема газочувствительного электрода показана на рис. 4.17.
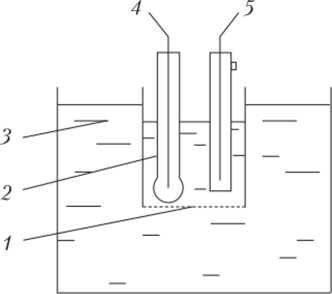
Рис. 4.17. Газоселективный электрод для определения NH4:
- 1 — гидрофобная газопроницаемая мембрана; 2 — внутренний раствор;
- 3 — анализируемый раствор; 4 — КН4+-сслсктивный электрод;
- 5 — электрод сравнения
Ферментные электроды — это датчики, в которых ионоселективный электрод покрыт пленкой, содержащей фермент, способный вызвать реакцию органического или неорганического вещества (субстрата) с образованием веществ (ионов, молекул), на которые реагирует электрод. В основе работы электрода лежит ферментативная реакция.
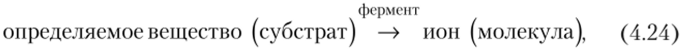
в результате которой образуется частица, обусловливающая отклик электрода. Поэтому за изменением ее концентрации можно проследить с помощью ионоселективного электрода. Селективность ферментных электродов очень высока, поскольку каждый фермент катализирует только какую-то определенную реакцию.
При соединении измерительного и вспомогательного электродов, погруженных в контролируемый раствор, образуется гальванический элемент (рис. 4.18). Его ЭДС равна алгебраической сумме потенциалов измерительного и вспомогательного электродов.

При постоянном потенциале вспомогательного электрода ЭДС измерительного элемента равна.

где Eq = /:() + Евспш — const. Следовательно, если известны нормальный потенциал измерительного электрода Е0 и потенциал вспомогательного ?|)С|ЮМ, ЭДС измерительного элемента пропорциональна активности ионов (4.13).
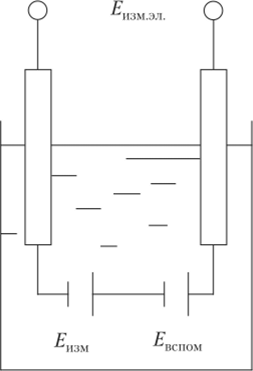
Рис. 4.18. Измерительный элемент рН-метра.
Для потенциометрического определения концентрации вещества в растворе применяют прямую потенциометрию и потенциометрическое титрование. Концентрацию вещества в прямой потенциометрии определяют методом градуировочного графика или методом добавок стандарта.
Как правило, электродная система имеет очень высокое электрическое сопротивление, около 108 Ом. Поэтому для измерения потенциала необходим электронный вольтметр (потенциометр), имеющий входное сопротивление порядка 1011—1012 Ом, либо потенциометр с ручным или автоматическим уравновешиванием.
Для более точных измерений потенциала в лабораторных условиях до сих пор применяют компенсационную схему, предложенную Погендорфом (J. Poggendorff— немецкий физик, 1796—1877).
Потенциометр Погендорфа (рис. 4.19) состоит из двух контуров — верхнего, включающего источник постоянного напряжения Ех, реостата Rx, и нижнего, состоящего из реостата R2 со шкалой, проградуированной в вольтах, двойного двухполюсного ключа П для введения в цепь стандартной ячейки Ест или измеряемой Е, гальванометра Г и ключа К.
В верхнем контуре постоянно течет ток. Перед измерением потенциала Е настраивают потенциометр по потенциалу стандартной ячейки ЕС[. Для этого ключом П в цепь вводят стандартную ячейку Ест, реостатом R2 устанавливают 1,0183 В и подбирают сопротивление Rx так, чтобы при кратковременном замыкании ключа К гальванометр Г показал отсутствие тока в нижнем контуре. Затем ключом П вводят в цепь Е и, замыкая ключ К на короткое время, перемещают движок реостата R2 до тех пор, пока в нижнем контуре не перестанет течь ток. Указатель движка реостата R2 указывает на величину Е.
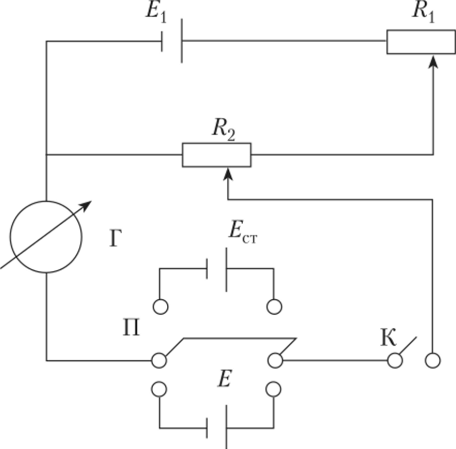
Рис. 4.19. Схема потенциометра Погендорфа
В аналитических лабораториях используют серийно выпускаемые цифровые вольтметры или вольтметры со шкалой, калиброванной в милливольтах и единицах pH. Эти приборы, называемые мономерами или pH-метрами, имеют входное сопротивление 1011 —1012 Ом.
Электронный вольтметр постоянного тока выполняют по схеме, показанной па рис. 4.20.

Рис. 4.20. Электронный вольтметр постоянного тока
Измеряемое напряжение Ux подается на входное устройство, представляющее собой многопредельный высокоомный делитель на резисторах. С делителя напряжение поступает на усилитель постоянного тока и далее — на вторичный прибор. Делитель и усилитель постоянного тока усиливают входное напряжение до значений, необходимых для нормальной работы вторичного прибора. Одновременно усилитель обеспечивает согласование высокого сопротивления входной цепи прибора с низким сопротивлением вторичного прибора.
Внешний вид одного из pH-метров показан на рис. 4.21. Он представляет собой многопараметрический микропроцессорный анализатор жидкости, предназначенный для измерения показателя активности pH (-1 — 14), рХ (-20…20), массовой С (0,01 — 10 000 мг/дм3) или молярной Ст (10_3—104) концентрации ионов, окислительно-восстановительного потенциала Eh (-3200—3200 мВ), температуры Т (-5…150°С) и концентрации кислорода в воде и водных средах (0—20 мг/дм3).

Рис. 4.21. Внешний вид рН-метра.
Структурная схема этого pH-метра показана на рис. 4.22.
Измерение pH основано на измерении ЭДС электродной системы, преобразуемой в дальнейшем в цифровой код и аналоговый выходной сигнал.
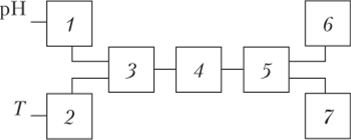
Рис. 4.22. Структурная схема рН-метра:
1,2 — входные усилители; 3 — коммутатор переключения режимов; 4 — АЦП; 5 — микропроцессор; 6 — контроллер дисплея; 7 — блок управления.
Задачи
4.2.1. Вычислите pH раствора соляной кислоты, в 50 мл которого содержится 1,825 г IIC1 (я = 0,78).
Решение
Если в 50 мл раствора содержится 1,825 г НС1, то 1000 мл раствора содержит х г. 1,825 1000.
Отсюда х = -—- = 36,5 г НС1. Раствор содержит 1 н, так как Эис1 = 36, э.
Концентрация ионов Н+ в растворе определяется нормальностью раствора N и степенью диссоциации я, т. е. Н+ = Na = 1Т0_10,78 = 0,078. Тогда pH = lgH+ = lg0,078 = = 0,11.
4.2.2. Вычислите pH 0,28%-го раствора соляной кислоты.
Решение
[ПСП = 1>008 + 35,457 = 7'71{Н моль/л— рН = -lg (7,7 10-2) = -lg7,7 + -lg10-2 = = -lg7,7 + 2 = 2 — 0,89 =1,11.
4.2.3. Вычислите pH 1/400 M раствора КОН, приняв, что едкое кали диссоциирует полностью.
Решение
При полной диссоциации [ОН-] = =2,5Т0_3 г-ион/л, рОН = 3 — lg2,5 = 3 —.
- -0,4 = 2,6, pH = 14−2,6 = 11,4.
- 4.2.4. Вычислите концентрацию ионов водорода и гидроксил-иона, если pH = = 10,33.
Решение 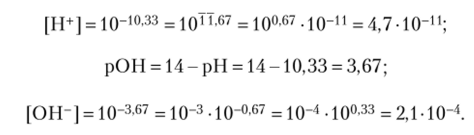
4.2.5. Вычислите pH 0,1%-го раствора соляной кислоты.
Ответ: pH = 1,56.
4.2.6. Вычислите pH 0,01%-го раствора соляной кислоты.
Ответ: pH = 2,56.
4.2.7. Вычислите pH 0,1%-го раствора азотной кислоты.
Ответ: pH = 1,80.
4.2.8. Вычислите pH 0,01%-го раствора азотной кислоты.
Ответ: pH = 2,80.
4.2.9. Вычислите pH 0,25%-го раствора азотной кислоты.
Ответ: pH = 1,40.
4.2.10. Вычислите pH 0,102%-го раствора азотной кислоты.
Ответ: pH = 1,79.
4.2.11. Вычислите pH 0,1%-го раствора хлорной кислоты.
Ответ: pH = 2,00.
4.2.12. Вычислите pH 0,027%-го раствора соляной кислоты.
Ответ: pH = 2,13.
4.2.13. Вычислите концентрацию ионов водорода и гидроксил-иона, если pH = = 9,48.
Ответ: [Н+] = 3,3 10″ 11 моль/л, [ОН ] = 3,02 10~5.
4.2.14. Вычислите концентрацию ионов водорода и гидроксил-иона, если pH = = 10,52.
Ответ: [Н+| =3,0 10 «моль/л, [ОН | =3,30 104.
4.2.15. Вычислите концентрацию ионов водорода и гидроксил-иона, если pH = = 0,15.
Ответ: [Н+] = 7,08−10_| моль/л, [ОН-] = 1,4МО-14.
4.2.16. Вычислите концентрацию ионов водорода и гидроксил-иона, если pH = = 7,72.
Ответ: [Н+] = 1,91−10-8 моль/л, [ОН-] =5,25−10-7.
4.2.17. Вычислите концентрацию ионов водорода и гидроксил-иона, если pH = = 0,30.
Ответ: [Н+] = 5,01 -10-1 моль/л, |ОН-] = 2,00−10-14.
4.2.18. Вычислите концентрацию ионов водорода и гидроксил-иона, если pH = = 11,32.
Ответ: [Н+] =4,79 10-12 моль/л, [ОН-] = 2,09−10-3.
4.2.19. Вычислите концентрацию ионов ОН-, если концентрация ионов водорода равна: а) 10-8 г-ион/л; б) 210-4 г-ион/л; в) 810-7 г-ион/л; г) 0,410-11 г-ион/л.
Ответ: а) МО-6; б) 5−10-11; в) 1,25-Ю-8; г) 2,5−10-3.
- 4.2.20. Вычислите концентрацию ионов Н+, если концентрация ионов ОН- равна:
- а) 4−10-ш г-ион/л; б) 1,6-Ю-13 г-ион/л; в) 5−10-6 г-ион/л; г) 3,2−10-7 г-ион/л.
Ответ: а) 2,5−10-5; б) 56,25−10-2; в) 2−10-0; г) 3,12−10-8.
4.2.21. Вычислите электродный потенциал цинка в 0,1 М растворе ZnCl2, а = 0,7. Решение
Активную концентрацию ионов Zn+ приближенно оцениваем равной 0,1 -0,7 = = 7• 10-2 г-ион/л. Электродный потенциал цинка в таком растворе равен.
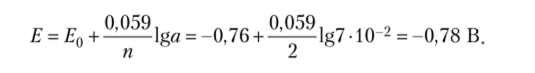
4.2.22. Вычислите ЭДС меднокадмиевого гальванического элемента, в котором активная концентрация ионов Cd2+ составляет 0,8 г-ион/л, а ионов Си2+ — 0,01 г-ион/л. Решение
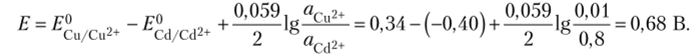
4.2.23. Вычислите ЭДС серебряно-кадмиевого гальванического элемента, в котором активные концентрации ионов Ag+ и Сс12+ соответственно составляют 0,1 и 0,005 г-ион/л.
Решение
Потенциалы отдельных электродов равны: ?Ag/Ag+ = 0,8 + 0,0591g0,1 = 0,8 — 0,059 =.
= 0,74 В, ЕСЛ Сй2+ = -0,40 + lg5 10−3 = -0,40 — 0,068 = -0,47 В, откуда? = 0,74 ;
- (-0,47) = 1,21 В. 2
- 4.2.24. Вычислите потенциалы металлов, находящихся в контакте с растворами их солей с заданной активной концентрацией катиона: a) Fe/FeSO^, [Fe2+] =0,01 г-ион/л;
- б) РЬ/РЬ (Ш3)2, [РЬ2+] =0,5 г-ион/л; в) Cr/Cr2(S04)2, [Сг3+] = 5−10″ 3 г-ион/л; г) Ag/ AgNO:i, [Ag+] = 6,3−10-3 г-ион/л.
Ответ: а) -0,499 В; б) -0,135 В; в) -0,785 В; г) 0,67 В.
4.2.25. Потенциал марганцевого электрода, помещенного в раствор его соли, составил -1,1 В. Вычислите концентрацию ионов Мп2+.
Ответ: 2,04? 10-2 г-ион/л.
4.2.26. При какой концентрации ионов Ag+ потенциал серебряного электрода составит 95% от величины его стандартного электродного потенциала?
Ответ: 0,21 г-ион/л.
4.2.27. Вычислите концентрацию ионов водорода в 0,1 М молярном растворе хлорноватистой кислоты НОС1 (К = 5−10−8).
Решение
Гк~ |5−10-8
Вычислим степень диссоциации НОС1 а = I—— =.——— = 7−10-4, откуда [Н+] =.
V^m V «I.
= а-СМ = 7−10−5 моль/л.
Задачу можно решить и другим способом:
[Н+ ] = у}К-См = V5 10-8 0, l = 7• 10″ 5 моль/л.
4.2.28. Концентрация ионов водорода в растворе составляет 10−3 моль/л. Определите pH этого раствора.
Решение
pH = -lg (4 • 10-3) = -(-3 + 0,60) = 2,40.
4.2.29. Определите концентрацию ионов водорода в растворе, pH которого равна 4,60.
Ответ: | Н+] = 2,5−10−5 моль/л.
4.2.30. Найдите молярную концентрацию ионов [Н+] в водных растворах, в которых концентрация гидроксид-ионов составляет МО-4, 3,2−10 (i и 7,4−10-'1 моль/л.
Ответ: 110-10, 3,12−10 9 и 1,35−10й моль/л.
4.2.31. Найдите концентрацию ионов водорода в растворах HN03 и HCN, если их молярная концентрация одинакова и равна 0,01 и 0,25 моль/л.
Ответ: HN03 — 2,2−10-3 и 1,12−10~2 моль/л; HCN — 2,8−10-" и 1,4-lQ-5 моль/л.
4.2.32. Найдите коэффициент диссоциации, а и [Н+] в растворах кислот: а) НСЮ — 0,001 моль/л; б) СН3СООН — 0,1 моль/л; в) HCN — 0,05 моль/л; г) HN03 — 0,02 моль/л.
Ответ: а) 7,07−10-4 и 7,07-Ю-5 моль/л; б) 1,34−10-1 и 1,34-Ю-4 моль/л; в) 1,26-Ю-4 и 6,2810~(> моль/л; г) 1,58-Ю-1 и 2,83−10_3 моль/л.
4.2.33. Чему равно значение pH растворов НС1 и NaOH концентрацией 0,1 моль/л?
Решение
Сильные кислоты и основания в водных растворах диссоциируют полностью, поэтому:
- а) [Н+] = СНС1 = 1(Н моль/л, следовательно, pH = 1;
- б) [ ОН-] = CNaOH = 10-‘ Моль/л, откуда рОН = 1. Поскольку | Н+] = К/| ОН-] = = 10_14/10_1 = 10-13 моль/л, то pH = 13 или pH = 14 — рОН = 14 — 1 = 13.
- 4.2.34. Какое значение имеет pH для растворов СН3СООН и N114ОН, если их концентрация равна 0,1 моль/л и а = 1,3%?
Решение
Концентрация ионов водорода в растворах слабых одноосновных кислот равна ее собственной молярной концентрации, умноженной на степень диссоциации: [Н+] = = Са, поэтому в растворе СН3СООН [Н+] = 0,1−0,013 = 1,3−10—3 моль/л и pH = 3 —.
- — lgl, 3 = 2,89. Аналогично, | ОН-] = 0,1−0,013 = 1,3−10″ 3 моль/л, рОН = 3 — lgl, 3 = 2,89, а pH = 14−2,89 = 11,11.
- 4.2.35. Вычислите pH растворов, в которых концентрация ионов [Н+] равна 2−10-7, 8,1-Ю-3 и 2,7−10—10 моль/л.
Ответ-. 6,70; 2,09; 9,57 pH.
4.2.36. ЭДС электродной системы, состоящей из измерительного стеклянного электрода и хлорсеребряного электрода сравнения, зависит от величины pH и температуры раствора следующим образом: Е= -203 — (54,16 -г 0,198?)(рН — 4,13) мВ. Определите координаты изопотенциальной точки, а также коэффициент преобразования системы.
Ответ: рП" = 4,123, Ен = -203 мВ, К = -(54,16 + 0,1980;
4.2.37. Определите коэффициент преобразования водородного электрода К и его зависимость от значения pH при? = 25 °C при следующих значениях постоянных уравнения Нернста: универсальная газовая постоянная R = 8,317 ДжДК-г-моль), число Фарадея Е= 96 522 Кл/г-экв.
ОтветК = -0,1984?, К = -59,12 мВ/pH.
- 4.2.38. Измерительный электрод имеет 7?изм = 50 МОм, электрод сравнения Rc"
- — 20 кОм. ЭДС, развиваемая системой, равна 500 мВ. Для ее измерения используют милливольтметр с диапазоном измерений 0—0,5 В и входным сопротивлением Rm = = 0,5 кОм. Какими будут показания милливольтметра?
Решение
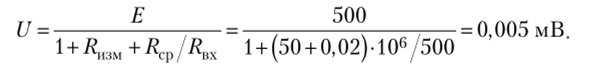
Показания милливольтметра являются практически нулевыми. Поэтому для измерения ЭДС электродных систем используют вольтметры с очень большим сопротивлением. Например, при RBX = 1 ГОм показания милливольтметра 17 = 476 мВ (погрешность 4,8%).
- 4.2.39. В каких случаях водородный электрод служит индикаторным электродом? Укажите правильный ответ:
- а) в реакциях окисления-восстановления;
- б) реакциях нейтрализации;
- в) реакциях осаждения;
- г) реакциях комплсксообразования.
Ответ: б.
Контрольные вопросы и задания
- 1. Что такое потепциометрия?
- 2. Потепциометрия является количественным или качественным методом анализа?
- 3. Напишите и объясните уравнение Периста.
- 4. Для какого класса веществ выведено уравнение Периста?
- 5. Что такое активность ионов, входящая в уравнение Периста?
- 6. Что представляет собой государственный первичный эталон единицы напряжения?
- 7. Назовите основные элементы электрохимической цепи.
- 8. Что такое равновесный потенциал? От чего он зависит?
- 9. Что такое водородный потенциал pH?
- 10. Что представляет собой государственный первичный эталон pH?
- 11. Какова шкала pH для водных растворов? Для неводных?
- 12. Чему равна pH нейтрального раствора? Почему?
- 13. Как меняется электродный потенциал стеклянного электрода при изменении температуры?
- 14. Что такое изопотенциальная точка?
- 15. Почему координаты изопотенциалыюй точки являются важнейшими характеристиками электродной системы?
- 16. Приведите классификацию потенциометрических анализаторов жидкости.
- 17. Что такое измерительный (индикаторный) электрод?
- 18. Что такое сравнительный электрод?
- 19. Расскажите об электродах первого рода. Какие существуют три их разновидности?
- 20. Расскажите об электродах второго рода.
- 21. Как устроен и работает хлорсеребряный электрод?
- 22. Как устроен и работает каломельный электрод?
- 23. Как устроен и работает стеклянный электрод?
- 24. Почему в некотором смысле стеклянный электрод является идеальным?
- 25. Как устроен мембранный (ионоселективный) электрод?
- 26. Почему входное сопротивление pH-метра должно быть очень велико (R > > 1011 Ом)?
- 27. В чем суть метода градуировочного графика?
- 28. В чем суть метода добавок стандарта?
- 29. Опишите потенциометр Поггендорфа.
- 30. Каким должно быть входное электрическое сопротивление электронного блока pH-метра?
- 31. Как работает иономер?