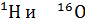Вопрос № 1. Строение, структура и изотопный состав молекул воды

Каждая молекула воды, обладающая двумя положительными и двумя отрицательными зарядами, способна образовать четыре так называемые водородные связи, т. е. соединения положительно заряженного ядра водорода (протона), химически связанного в одной молекуле с отрицательно заряженным атомом кислорода, принадлежащим другой молекуле. Вода — это простейшее устойчивое в обычных условиях химическое… Читать ещё >
Вопрос № 1. Строение, структура и изотопный состав молекул воды (реферат, курсовая, диплом, контрольная)
Вода — это простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом. В чистом виде вода — вещество бесцветное, не имеющее ни вкуса, ни запаха.
Молекула воды несимметрична: три ядра образуют равнобедренный треугольник с двумя ядрами водорода в основании и ядром кислорода в вершине.
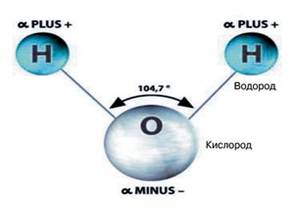
Атом кислорода в молекуле воды присоединяет к себе два электрона, отнятых от атомов водорода, и тем самым приобретает отрицательный заряд. В свою очередь, оба атома водорода, лишены электронов, становятся положительно заряженными протонами. Молекула воды, поэтому образует электрический диполь. изотопный вода озеро волна Полярное строение воды и возникающее в воде электрическое поле обусловливают большую диэлектрическую проницаемость воды — величину, показывающую, во сколько раз силы взаимодействия электрических зарядов уменьшаются в воде по сравнения с силами их взаимодействия в вакууме. Вода способна расщеплять молекулы других веществ, что обусловливает сильное растворяющее действие воды.
Каждая молекула воды, обладающая двумя положительными и двумя отрицательными зарядами, способна образовать четыре так называемые водородные связи, т. е. соединения положительно заряженного ядра водорода (протона), химически связанного в одной молекуле с отрицательно заряженным атомом кислорода, принадлежащим другой молекуле.
Водяной пар состоит преимущественно из одиночных молекул воды, т. е. водородные связи практически не реализуются. В твердом состоянии (лед) строение воды в высокой степени упорядочено. Такая структура весьма рыхлая и, как иногда говорят, «ажурная». Вода в жидком состоянии занимает промежуточное положение между паром и льдом. В такой воде сохраняются элементы «льдоподобного» молекулярного каркаса, а его пустоты частично заполняются одиночными молекулами. Поэтому «упаковка» молекул в воде, находящейся в жидком состоянии, более плотная, чем у льда, и плавление льда приводит не к уменьшению, а к увеличению плотности. При повышении температуры происходит увеличение объема воды вследствие роста интенсивности теплового движения молекул. В диапазоне повышения температуры от 0 до 4 °C преобладает процесс уплотнения воды, при температуре выше 4 °C — тепловое расширение. Поэтому вода обладает «аномальным» свойством — наибольшей плотностью не при температуре плавления, а при 4 °C.
Водород и кислород имеют несколько природных изотопов: №Н (обычный водород), ІН, или В (тяжелый водород, или дейтерий), іН, или Т (радиоактивный сверхтяжелый водород, или тритий). Поэтому и сама вода имеет переменный изотопный состав. Природная вода — это смесь вод разного изотопного состава. Наиболее распространенная вода, состоящая из изотопов, доля других изотопных воды ничтожна — менее 0,27%. Воду с изотопным составом №Н2 О называют обычной водой и обозначают просто Н2О, остальные виды воды (кроме іН2О) называют тяжелой водой. Иногда тяжелой водой считают лишь дейтериевую воду. Вода с изотопным составом іН2О (или Т2О) — так называемая сверхтяжелая вода. Ее на Земле находится всего 13 — 20 кг.