Результаты исследования.
Системный подход к банкированию пуповинной крови для восстановительной медицины

Скрининг состава и характеристик клеток пуповинной крови, проводимый при помощи автоматических счетчиков клеток крови в работе банков ПК не вполне удовлетворителен, поскольку ПК имеет некоторые физиологические отличия от периферической крови взрослого человека, а большинство автоматических анализаторов крови откалиброваны под нормативы крови взрослого человека. Современные гематологические… Читать ещё >
Результаты исследования. Системный подход к банкированию пуповинной крови для восстановительной медицины (реферат, курсовая, диплом, контрольная)
В развитии клеточного направления восстановительной медицины чрезвычайно актуален вопрос подготовки достаточного количества эффективного и безопасного клеточного материала, применение которого при различных заболеваниях повысит регуляторные, компенсаторные и адаптивные механизмы возможности организма.
Особенности клеточного состава ПК новорожденных
Результаты исследования количества клеток и их основных параметров при помощи автоматического гематологического счетчика были проанализированы и представлены в таблице 2.
Таблица 2. Референтные значения клеточного состава ПК
Лейкоцитарная формула. | (M+m), n=3964. | |
WBC/(109/л. | 17,24 + 0,16. | |
NEU/(109/л. | 8,41 + 0,10. | |
LYM/(109/л. | 5,54 + 0,06. | |
MON/(109/л. | 2,42 + 0,03. | |
EOS/(109/л. | 0,64 + 0,01. | |
BAS/(109/л. | 0,23 + 0,01. | |
RBC /(1012/л). | 4,40 + 0,01. | |
HGB/(г/л). | 157,4 + 0,46. | |
HCT (%). | 32,29 + 0,14. | |
MCV/(фл). | 105,81 + 0,12. | |
MCH/(пг). | 35,83 + 0,04. | |
MCHС/(пг). | 338,6 + 0,24. | |
RDW (%). | 12.71 + 0,02. | |
MCH/(пг). | 35,83 + 0,04. | |
PLT / /(109/л. | 307,54 + 1,97. | |
MPV / (фл). | 7,18 + 0,02. | |
Скрининг состава и характеристик клеток пуповинной крови, проводимый при помощи автоматических счетчиков клеток крови в работе банков ПК не вполне удовлетворителен, поскольку ПК имеет некоторые физиологические отличия от периферической крови взрослого человека, а большинство автоматических анализаторов крови откалиброваны под нормативы крови взрослого человека. Современные гематологические анализаторы являются специализированными автоматизированными приборами с компьютерной обработкой сигналов с неоспоримыми преимуществами (высокая производительность, возможность практически полной автоматизации, высокая информативность и точность) по сравнению с ручными методами. ПК характеризуется тем, что наряду со зрелыми элементами нейтрофильного ряда, содержит повышенное количество палочкоядерных нейтрофилов и более молодые формы — метамиелоциты и миелоциты.
При исследовании ПК окрашенные мазки оценивались с помощью световой микроскопии. Полученные результаты (средние величины по группе) затем сравнивались с величинами, полученными при исследовании тех же образцов пуповинной крови при помощи автоматического анализатора клеток крови. Отмечено, что при автоматическом анализе занижается процентное соотношение нейтрофилов, а лимфоцитов, моноцитов, эозинофилов и базофилов увеличивается. Все изменения были статистически достоверны (табл.3.).
Таблица 3. Различия клеточного состава ПК при подсчете клеток при помощи автоматического анализатора и светооптической микроскопии, в %.
Лейкоцитарная формула. | Автоматический анализ (M+m), n=3964. | Ручной подсчет (M+m), n=3964. | |
NEU. | 47,48+ 0,44. | 57,48+ 0,47. | |
LYM. | 32,76+ 0,36. | 28,66+ 0,43. | |
MON. | 14,64 0,124. | 9,95+ 0,19. | |
EOS. | 3,86+ 0,10. | 3,28+ 0,13. | |
BAS. | 3,41+ 0,04. | 0,61+ 0,03. | |
Прмечание. p<0,0001-степень достоверности отличий Показано, что при большом содержании в ПК лейкоцитов увеличивается степень различий в определении в ПК базофилов (r=-0,44, p<0,0001), лимфоцитов (r=-0,25, p<0,0001), нейтрофилов (r=-0,22, p<0,0005). При большом содержании в ПК нормобластов увеличивается степень различий в определении в ПК базофилов (r=-0,36, p<0,0001), лимфоцитов (r=-0,4, p<0,0001), нейтрофилов (r=-0,27, p<0,0001). Полученные закономерности не зависели от сроков гестации, степени разведения образца ПК антикоагулянтом, времени, прошедшего после родов до начала сбора и обработки ПК.
Иммунологическая характеристика клеточного состава ПК (количество CD34+ клеток в ПК) определялась с помощью проточной цитометрии и оценивалась как 2 параметра: процент от общего количества лейкоцитов — 0,827+ 0,023 и абсолютное количество CD клеток — 0,100+0,003 в 1мл ПК.
Оценивалось количество CD34+CD133+ клеток, как наиболее ранних предшественников гемопоэза, количество CD133+ клеток и их субпопуляций CD133+CD31+ — эндотелиальные предшественники, CD133+CD106+ — мезенхимальные стволовые клетки, количество пролиферирующих гемопоэтических предшественников по уровню экспрессии трансферринового рецептора (CD71) в ПК и концентрате — достоверных различий не было выявлено, что говорит о качестве полученного концетрата стволовых клеток.
Количество колоний оценивалось на 105 MNC и на 1 мл ПК. Также подсчитывался процент колоний каждого вида от их общего количества., было выявлено преобладание ранних ГСККОЕ-ГЕММ-35,3% (рисунок 1.).

Рисунок 1. Распределение колониеобразующих единиц пуповинной крови.
Была выявлена статистически значимая положительная корреляционная взаимосвязь как между процентом CD34+ клеток в ПК и количеством КОЕ-mix в 1 мл образца (r=0,231; р=0,013), так же и абсолютным количеством CD34+ клеток в ПК и КОЕ-mix в 1 мл образца (r=0,3888; р=0,001), КОЕ-ГМ (r=0,4285; р=0,001), КОЕ-Г (r=0,2887; р=0,0018), КОЕ-М (r=0,3197; р=0,0005) и общим количеством КОЕ в мл образца (r=0,4187; р=0,001). Прямых корреляционных взаимосвязей между сроком гестации и количеством КОЕ не было выявлено.
Уровень некроза лейкоцитов ПК составил 3,49 ± 0,28%, при этом, уровень некроза лимфоцитов был ниже значений всех лейкоцитов (2,99 ± 0,34%) и статистически значимо отличался от уровня некроза моноцитов и гранулоцитов, составлявшего 5,59 ± 0,72% и 6,12 ± 0,65% соответственно (р < 0,0001) (рис. 2.).
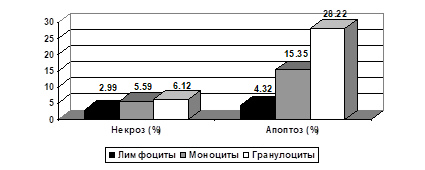
Рисунок 2. Уровень некроза и спонтанного апоптоза лейкоцитов ПК Уровень спонтанного апоптоза лейкоцитов составил 9,18 ± 1,19%, при этом, уровень спонтанного апоптоза лимфоцитов, был также ниже значений в общей группе (4,32 ± 0,7%), и также статистически значимо отличался от уровня спонтанного апоптоза моноцитов и гранулоцитов, составившего 15,35 ± 2,02% и 28,22 ± 2,51% соответственно (р < 0,0001).
Такое соотношение показателей позволяет предположить большую жизнеспособность лимфоцитов, что представляется позитивным результатом, учитывая тот факт, что популяция ГСК находится в пуле лимфоцитов. Это предположение подтверждается положительной корреляционной взаимосвязью количества лимфоцитов и колониеобразующей активностью ПК (табл. 4.).
Таблица 4. Взаимосвязь количества лимфоцитов и колониеобразующей активности ПК.
Лимфоциты. | |||
r. | р | ||
KOE-mix. | 0,399. | < 0,001. | |
КОЕ-ГМ. | 0,4993. | < 0,001. | |
КОЕ-Г. | 0,4467. | < 0,001. | |
КОЕ-М. | 0,4995. | < 0,001. | |
КОЕ-Эр | 0,2068. | 0,0018. | |
КОЕ-сумма. | 0,5634. | < 0,001. | |
При изучении взаимосвязи уровня спонтанного апоптоза лимфоцитов и колониеобразующей активности клеток пуповинной крови и оказалось, что отмечается положительная корреляционная взаимосвязь между уровнем спонтанного апоптоза лимфоцитов и колониеобразующей активностью пуповинной крови, что доказывает однонаправленность процессов апоптоза и пролиферации (табл. 5.).
Таблица 5. Взаимосвязь уровня апоптоза лимфоцитов и колониеобразующей активности ПК
Доля лимфоцитов на разных стадиях апоптоза. | |||
r. | p. | ||
KOE-mix. | 0,4427. | 0,0208. | |
КОЕ-ГМ. | 0,2948. | 0,1525. | |
КОЕ-Г. | 0,3537. | 0,0828. | |
КОЕ-М. | 0,3003. | 0,1447. | |
КОЕ-Эр | — 0,1221. | 0,544. | |
КОЕ-сумма. | 0,3677. | 0,0706. | |
При исследовании клеточного состава ПК в зависимости от пола было выявлено, что у девочек уровень лейкоцитов выше (17,74±0,24×109/л; М±m), чем у мальчиков (16,8±0,23×109/л; р=0,005), преимущественно за счет нейтрофилов, которых у девочек больше, а лимфоцитов, моноцитов и эозинофилов меньше. В абсолютных количествах у девочек также больше нейтрофилов, а меньше эозинофилов (табл. 6.).
Таблица 6. Процентное соотношение клеток в лейкоцитарной формуле в зависимости от пола новорожденного (M+m).
Пол. | WBC. (109/л). | Лейкоцитарная формула (%). | ||||||
NEU. | LYM. | MON. | EOS. | BAS. | ||||
Девочки. | n. | |||||||
M+m. | 17,74+ 0,24. | 49,97+ 0,35. | 31,57+ 0,15. | 13,75. | 3,48+ 0,07. | 1,26+0,03. | ||
Мальчики. | n. | |||||||
M+m. | 16,80+0.23. | 47,10+0.34. | 33,23+0.30. | 14,29+0.17. | 4,16+0.09. | 1,18+0.03. | ||
р | 0,005. | < 0,001. | < 0,001. | 0,018. | < 0,001. | 0,06. | ||
Девочки. | n. | |||||||
M+m. | 17,74+ 0,24. | 8,93+0.14. | 5,5+0.093. | 2,44+0.04. | 0,60+0.01. | 0,24+0.01. | ||
Мальчики. | n. | |||||||
M+m. | 16,80+0.23. | 7,94+0.12. | 5,54+0.09. | 2,40+0.05. | 0,68+0.02. | 0,22+0.02. | ||
р | < 0,001. | 0,938. | 0,537. | < 0,001. | 0,158. | < 0,001. | ||
Количество эритроцитов (4,33±0,02×1012/л) и содержание гемоглобина (155,1±0,7 г/л) у девочек меньше, чем у мальчиков (4,46±0,02×1012/л; 159,5±0,6 г/л; р<0,0001). Гематокрит у девочек (31,79±0,2%) также меньше, чем у мальчиков (32,76±0,19%; р=0). Различий в эритроцитарных индексах (MСV, MCH, MCHC, RDW) в зависимости от пола новорожденного не обнаружено. Количество тромбоцитов у девочек (314,87±2,98×109/л) больше, чем у мальчиков (300,72±2,62×109/л; р<0,0001). Средний размер тромбоцитов не имеет различий.
Было выявлено, что у мальчиков CD34+ клеток больше в процентном (0,88±0,03 — мальчики; 0,77±0,03 — девочки; р=0,01) и в абсолютном количестве (0,106±0,005 — мальчики; 0,095±0,005 — девочки; р=0,002) (табл. 7.).
Таблица 7. Количество CD34+ клеток в пуповинной крови доношенных новорожденных мальчиков и девочек.
Пол ребенка. | Параметры. | CD34 (%). | CD34 (10і/mmі). | |
Девочки Мальчики. | n. | |||
M+m. | 0,769+0,032. | 0,095 +0,005. | ||
n. | ||||
M+m. | 0,883 +0,032. | 0,106+ 0,005. | ||
р | 0,01. | 0,002. | ||
При анализе данных колониеобразующей активности ПК выявлено, что у мальчиков статистически значимо большее количество КОЕ-ГМ в 1 мл ПК (745,71±65,11 — девочки; 1216,7±185,45 — мальчики; р=0,022), и имеется тенденция к увеличению (статистически незначимо) количества КОЕ-М (691,64±78,6 — девочки; 1052,1±252,09 — мальчики; р=0,19) и общего количества колоний (4883,13±455 — девочки; 6070,8±691 — мальчики; р=0,16) в 1 мл образца ПК. При анализе эффективности клонирования (на 105 MNC) у мальчиков также больше КОЕ-Г (18,44±1,31 — девочки; 22,42±1,6 — мальчики; р=0,058). В процентном соотношении имеется тенденция к увеличению количества КОЕ-mix (р=0,11) у девочек, и уменьшению у них КОЕ-ГМ (р=0,13) и КОЕ-Эр (р=0,14).
Связь клеточного состава с массой тела новорожденного очень слабая: достоверная положительная корреляция с массой тела ребенка обнаружена для нейтрофилов (r=0,12; р=0,0002), эозинофилов (r=0,14; р=0,0001), базофилов (r=0,12; р=0,0002) и гематокрита (r=0,2; р4000 г. При сравнении полученных данных отмечено, что с увеличением массы тела ребенка при рождении увеличивается количество лейкоцитов — от 15,52±0,59×109/л в группе с массой тела 2,5−3 кг до 17,51±0,44×109/л в группе с массой тела >4 кг (р=0,01). Также увеличивается абсолютное количество нейтрофилов и эозинофилов (р<0,0001 и р=0,004, соответственно), а количество моноцитов уменьшается (р4 кг; р<0,0001). Отмечено также уменьшение MCHC (р<0,0001) и увеличение MPV (р=0,025) с увеличением веса ребенка. При проведении регрессионного анализа достоверных корреляционных взаимосвязей количества CD34+клеток и колониеобразующей активностью ПК и массы ребенка при рождении не получено. Наиболее статистически значимо увеличение среди KOE-mix (р=0,096).
Влияние технологического процесса на биологические свойства ПК
Известно несколько методов редукции объема ПК, но очевидны и некоторые их недостатки, например, длительный процесс центрифугирования, неудобный для производственного потока банков пуповинной крови и недостаточная надежность, сильно связанная с опытом и квалификацией оператора. Был разработан и внедрен в эксплуатацию принципиально новый клеточный сепаратор, адаптированный к клеточным суспензиям малого объема (Sepax, Biosafe S.A., Eysins/Nyon, Швейцария). Эта система состоит из компьютеризированной автоматизированной процедуры цитафереза, гарантирующей очень эффективную редукцию объема и маленькое количество эритроцитов в конечном продукте в функционально замкнутой системе. Конечный продукт собирается прямо в мешки для замораживания и может быть заморожен немедленно после добавления диметилсульфоксида (ДМСО). Однако, ряд факторов, влияющих на клеточный состав и характеристики клеток пуповинной крови, может выходить за стандартные рамки программирования процесса сепарации требовать использования метода двойного центрифугирования. Для этого сравнили эффективность метода автоматического выделения клеточного концентрата ПК при помощи технологии Sepax и метода двойного центрифугирования оператором с использованием гидрооксиэтилированного крахмала (HES) в условиях ситуаций, влияющих на клеточный состав ПК, равных для каждого из методов.
Проводимая для уменьшения объема ПК крови процедура лейкоконцентрации, основанная на седиментации эритроцитов раствором гидроксиэтилкрахмала, влияет на соотношение количества клеток ПК, так как, вероятно, степень потери различных субпопуляций лейкоцитов отличается. Полученные данные представлены в таблице 8.
Таблица 8. Клеточный состав ПК и концентрата (х 109/л).
Виды клеток Параметры. | WBC. | NEU. | LYM. | MON. | EOS. | BAS. | |
Клеточный состав ПК (х 109/л). | |||||||
n. | |||||||
M+m. | 17,24+ 0,48. |
|
|
|
|
| |
Клеточный состав концентрата ПК (х 109/л). | |||||||
n | |||||||
M+m |
|
|
|
|
|
| |
Показано, что при проведении процедуры концентрации ПК, основанной на процессе седиментации эритроцитов под действием гидроксиэтилкрахмала, доля нейтрофилов не изменяется, доля лимфоцитов статистически значимо повышается (рис.3) за счет того, что доля моноцитов, эозинофилов и базофилов статистически значимо снижается (рис.4). Это, по-видимому, связано с большей потерей этих клеток при концентрации.
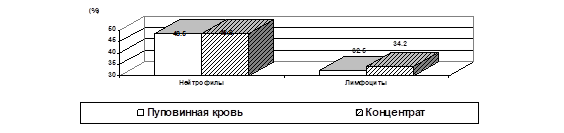
Рисунок 3. Доля нейтрофилов и лимфоцитов в пуповинной крови и концентрате мононуклеарной фракции ПК.
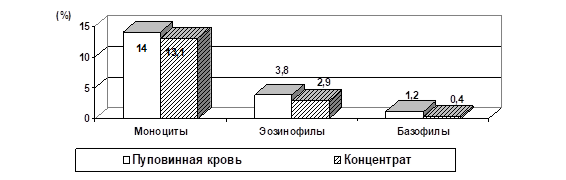
Рисунок 4. Доля моноцитов, эозинофилов и базофилов в ПК и концентрате мононуклеарной фракции ПК.
Абсолютное количество субпопуляций лимфоцитов (CD3+клетки, CD19+клетки, CD3+CD4+клетки, CD3+CD8+клетки, CD16+CD56+клетки, HLA-DR+клетки) также повышается в процессе процедуры концентрации, но статистически незначимо. Степень повышения повторяет динамику лимфоцитов, определенную при помощи автоматического счетчика клеток крови.
Полученные данные позволили охарактеризовать состав лимфоцитов ПК и продемонстрировали отсутствие влияния процедуры концентрации ПК на количество и состав CD3+лимфоцитов в сочетании с достоверным увеличением после концентрации доли NK-клеток и CD33+CD13+клеток. Доля натуральных киллеров (NK) CD16+CD56+клеток среди ядросодержащих клеток пуповинной крови составила 5,97 ± 0,67% и статистически значимо увеличилась после процедуры концентрации — 8,54 ± 0,91% (р = 0,027). Такое соотношение связано с тем, что при проведении процедуры концентрации лейкоцитов ПК, происходит статистически незначительная потеря лейкоцитов вместе с седиментирующимися эритроцитами, за счет эозинофилов, базофилов и моноцитов и, следовательно, относительное количество NK-клеток и миелоидных предшественников возрастает. Количество CD3+лимфоцитов, опосредующих развитие РТПХ, в результате процедуры лейкоконцентрации практически не менялось и составило 17,9 ± 1,44% и 19,2 ± 1,4% от всех ядросодержащих клеток соответственно. Количество и соотношение субпопуляций CD3+лимфоцитов — CD3+CD4+клеток и CD3+CD8+клеток в процессе концентрации также не изменилось и составило до концентрации CD3+CD4+клетки — 12,62 ± 1,12%, CD3+CD8+клетки — 5,62 ± 0,53%; после концентрации CD3+CD4+клетки — 13,23 ± 1,12%, CD3+CD8+клетки — 5,52 ± 0,48% от всех ядросодержащих клеток. Относительное количество предшественников миелопоэза — D33+CD13+клеток составила 12,5 ± 0,76% и статистически значимо увеличилось 15,82 ± 0,81% (р=0,005) после процедуры выделения, что может быть связано с большей поте…
Количество CD15+клеток имело тенденцию к снижению, по-видимому, вследствие большей потери при процедуре выделения по сравнению с остальными субпопуляциями лейкоцитов и составило 39,32 ± 3,45% до выделения и 35,23 ± 3,26% после.
Полученные данные имеют важное практическое значение при проведении планирования технологического процесса, так как показано, что при проведении процедуры концентрации ПК, основанной на процессе седиментации эритроцитов под действием гидроксиэтилкрахмала, доля нейтрофилов не изменяется, доля лимфоцитов статистически значимо повышается за счет снижения доли моноцитов, эозинофилов и базофилов. Процедура лейкоконцентрации не влияет на количество CD3+клеток, в том числе CD3+CD4+клеток и CD3+CD8+клеток и активированных лимфоцитов — CD25+клеток.
В результате процедуры лейкоконцентрации статистически значимо увеличилась доля CD19+клеток и натуральных киллеров (NK) CD16+CD56+клеток. Процедура лейкоконцентрации не влияет на содержание CD34+клеток CD133+клеток и субпопуляций. Таким образом, результаты работы позволили получить референтные значения показателей состава лейкоцитов ПК, которые рекомендуется использовать в качестве факторов определяющих показания и противопоказания к сбору ПК для безвозмездного донорства ГСК.
При сравнении полученных результатов выявлено, что при аппаратном методе обработки пуповинной крови (МАВК) выделение лейкоцитов в целом меньше, чем при ручном (двойном центрифугировании) (72,4±0,45 — ручной; 70,28±0,51 — аппаратный; p=0,002). Однако выделение мононуклеаров и лимфоцитов значительно выше, чем при ручном методе (MNC: 70,11±0,49 — ручной; 77,94±0,53 — аппаратный; p<0,0001; лимфоциты: 71,7±0,54 — ручной; 80,73±0,58 — аппаратный; p<0,0001). Редукция же эритроцитов при аппаратном методе выделения значительно выше, чем при ручном (36,45±0,51 — ручной; 20,85±0,5 — аппаратный; p<0,0001).
Оптимизация исследования HLA-фенотипа пуповинной и периферической крови у пациентов при различных заболеваниях
Типирование пуповинной крови по HLA-системе имеет свои специфические особенности: быстрота обработки большого количества биоматериала при ограниченном количестве крови каждого образца и невозможности его повторного сбора. Поэтому использование чувствительных методов HLA-типирования, требующих для исследования минимального количества ДНК, является критическим фактором.
Впервые в России была апробирована и успешно внедрена технология обратной дот-блот гибридизации с олигонуклеотидными зондами (SSO) в автоматическом режиме на процессоре Dynal autoRELI™ 48 mk, позволяющая проводить скрининговое HLA-типирование большого количества образцов. Одним из несомненных достоинств этой технологии является ее большая пропускная способность и возможность использования минимального количества исследуемого материала — около 40 мкл ДНК (концентрация 13 — 15 мкг/мкл). Весь рабочий процесс осуществляется за 2,5 часа. Однако, основным недостатком данного метода является возникновение двойных интерпретаций результатов типирования. Особенно это касается локусов HLA-B и HLA-DRB (около 13% случаев по каждому из них). По локусу HLA-A было получено около 6% случаев с неоднозначной интерпретацией результатов, по локусу HLA-Cw — 8,5% случаев, по HLA-DQB1- 1,5%. Для разрешения неоднозначной интерпретации результатов типирования этих образцов проводилось повторное типирование с применением метода ПЦР с аллель-специфическими праймерами (SSP), что позволило достичь 100% однозначности результатов.
Для разрешения двойной интерпретации был использован метод типирования с помощью аллель-специфических праймеров (SSP). Интерпретация полученных данных осуществлялась с помощью таблиц, где определенная комбинация сигнальных полосок соответствовала определенной группе аллелей гена.
В настоящее время в реестре неродственных доноров хранится 3964 образца ГСК, типированные по пяти локусам системы HLA-A, -B, -Cw, -DRB, -DQB1. Были выявлены 17 специфических групп аллелей локуса HLA-A, 32 специфичности локуса HLA-B, 14 специфичностей локуса HLA-Cw, 14 специфичностей гена HLA-DRB1 и 5 специфичностей гена DQB1. Частота тех или иных генов гистосовместимости среди доноров стволовых клеток во многом зависит от этнических признаков входящих в неё лиц.
Анализ распределения HLA-специфичностей (специфических групп аллельных вариантов) у московской популяции определил, что наиболее часто встречаемыми по локусам класса I являются (в долях): HLA-A*02 (0,288), A*03 (0,134), A*01 (0,114), A*24 (0,096); HLA-B — B*07 (0,120), B*35 (0,0793), B*44 (0,101), B*18 (0,084), B*08 (0,067), B*13 (0,066); Cw*07 (0,257), Cw*12 (0,134), Cw*06 (0,130), Cw*04 (0,0128).
По классу II c наибольшей частотой встречаются следующие группы аллелей гена DRB1 — *07 (0,143), *13 (0,139), *15 (0,133), *11 (0,130), *01 (0,110), *04 (0,110) и группы аллелей гена DQB1 — *03 (0,330), *06 (0,222). Наиболее редко встречающимися группами аллелей были выявлены следующие: A* 69 (0,0033), A*34 (0,35), A*80 (0,35), B*47 (0,0036), B* 45 (0,002), B*46 (0,002), B*53 (0,0017), B* 73 (0,0015), B*54 (0,0003) и B*78 (0,0003).
Проведенные исследования и анализ литературных данных (Зарецкая Ю.М., 2008) свидетельствуют, что характер распределения генных частот HLA класса I и II в популяции московского региона в целом соответствуют таковому для европеоидов.
Характер распределения частоты встречаемости генов HLA-системы у детей с ОЛЛ.
Были обследованы 187 детей с ОЛЛ из различных регионов России. Для изучения характера распределения генов HLA-системы пациенты, больные ОЛЛ, были разделены в зависимости от их иммунологического варианта на 2 группы: на В-ОЛЛ и Т-ОЛЛ. Была исследована группа из 98 детей с В-ОЛЛ (57 мальчиков и 41 девочка) (средний возраст составил 8,2 лет ± 4,8). Особенности характера распределения генов гистосовместимости в этой группе больных по сравнению с контрольной группой здоровых детей представлены на рис. 5 и в таблице 9.
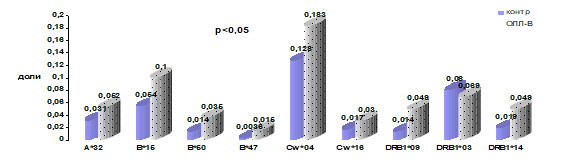
Рисунок 5. Частота встречаемости HLA-специфичностей у детей, больных В-ОЛЛ.
Частота встречаемости генов HLA-системы была высокой в группе больных В-ОЛЛ по сравнению со здоровыми детьми по локусу HLA-A — A*32; по локусу HLA-B — B*15, B*50; В*47 по локусу HLA-C — Cw*04; Сw*16 по локусу HLA-DRB — DRB1*09 и DRB1*14.
Для изучения факторов риска развития заболевания использовали метод случай-контроль. Если этот показатель превышал OR > 2, то он считался значимым (Зарецкая Ю.М., 1983). При разделении пациентов по полу были выявлены особенности распределения в частоте встречаемости HLA-специфичностей с этим заболеванием (рис. 6). В контрольной группе различий по полу выявлено не было.
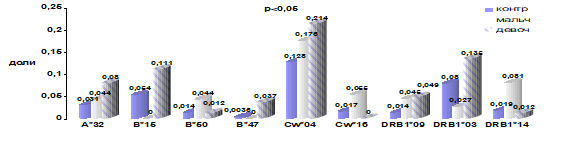
Рисунок 6. Частота встречаемости HLA-специфичностей у мальчиков и девочек В-ОЛЛ.
Таблица 9. Иммуногенетические факторы предрасположенности и устойчивости к развитию В — ОЛЛ у детей.
HLA; специфичности. | Дети (мальчики и девочки) n=98. | Мальчики n=57. | Девочки n=41. | ||||||||||
p. | OR. | CI. | EF/. PF,%. | p. | OR. | CI. | EF/. PF,%. | p. | OR. | CI. | EF/. PF,%. | ||
A*32. | 0,04. | 2,1. |
| 5,7. | ; | ; | ; | ; | 0,03. | 2,9. |
| 10,2. | |
B*15. | 0,002. | 2,3. |
| 11,80. | ; | ; | ; | ; | 0,02. | 2,6. |
| 13,8. | |
B*50. | 0,03. | 2,6. |
| 4,3. | 0,03. | 3,3. |
| 6,2. | ; | ; | ; | ; | |
B*47. | ; | ; | ; | ; | ; | ; | ; | ; | 0,009. | 10,9. |
| 6,8. | |
Cw*04. | 0,007. | 1,9. |
| 17,4. | 0,05. | 1,95. |
| 18,3. | 0,02. | 2,56. |
| 27,1. | |
Cw*16. | ; | ; | ; | ; | 0,016. | 3,7. |
| 8.1. | ; | ; | ; | ; | |
DRB1*03. | ; | ; | ; | ; | 0,037. | 0,3. In:3,4. |
| 11,0. | 0,04. | 2,2. |
| 15,5. | |
DRB1*09. | 0,0011. | 3,5. |
| 6,3. | 3,3. | 3.3. |
| 6,4. | 0.05. | 4,0. |
| 7,5. | |
DRB1*14. | 0,002. | 3,1. |
| 6,6. | 1,95. | 5,1. |
| 13,0. | ; | ; | ; | ; | |
n — количество больных детей; р — уровень достоверности;
OR (odds ratio) — отношение шансов; In — инвертированный показатель (1/OR).
CI (confidence interval) — доверительный интервал; EF/PF — этиологическая /превентивная фракция Были исследованы 37 детей больных Т-ОЛЛ (25 мальчиков и 12 девочек) (средний возраст составил 10,1 лет ± 4,9). Отличительные особенности характера распределения HLA-генов в этой группе по сравнению со здоровыми детьми представлены на рис. 7 и табл. 10.
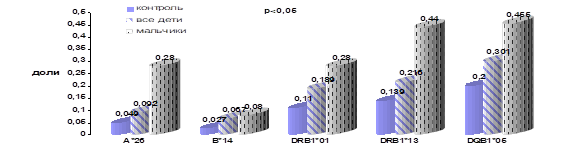
Рисунок 7.Частота встречаемости специфичностей HLA у детей больных Т-ОЛЛ.
Таблица 10. Иммуногенетические факторы предрасположенности к развитию T-линейного ОЛЛ у детей.
HLA-специфичности. | Дети (мальчики и девочки), n=37. | Мальчики, n=25. | |||||||
p. | OR. | CI. | EF,%. | p. | OR. | CI. | EF,%. | ||
A*26. | ; | ; | ; | ; | 0,006. | 3,7. |
| 20,0. | |
B*14. | 0,05. | 3,0. |
| 9,5. | ; | ; | ; | ; | |
DRB1*01. | 0,0035. | 2,2. |
| 19,8. | ; | ; | ; | ; | |
DRB1*13. | 0,002. | 2,35. |
| 25,5. | 0,03. | 2,55. |
| 29,0. | |
DQB1*05. | 0,002. | 2,45. |
| 34,5. | ; | ; | ; | ; | |
р — уровень достоверности; OR (odds ratio) — отношение шансов, CI (confidence interval) — доверительный интервал, EF— этиологическая фракция Общая группа (все ОЛЛ) была представлена 187 детьми (112 мальчиков и 75 девочек) (средний возраст составляла 8,0 лет ±). При анализе полученных данных были выявлены отклонения в распределении частоты встречаемости HLA-специфичностей В*50, Cw*04, DRB1*09, DRB1*14 по сравнению с контрольной группой здоровых детей (табл. 11).
Таким образом, можно заключить, что варианты В-ОЛЛ и Т-ОЛЛ имеют разные иммуногенетические маркеры предрасположенности и устойчивости к данным заболеваниям. Более того, выявленные маркеры имеют разную силу ассоциации с заболеванием в зависимости от пола ребенка. Обнаружено, что у мальчиков и у девочек имеются свои специфические маркеры к разным иммунофенотипическим вариантам ОЛЛ.
Таблица 11. Иммуногенетические факторы предрасположенности и устойчивости к развитию ОЛЛ у детей, (общая группа, n=187).
HLA; специфичности. | Маркеры предрасположенности. | Маркеры устойчивости. | |||||||||
р | CI. | OR. | CI. | EF,%. | р | CI. | OR. | CI. | PF,%. | ||
B*37. | 0,017. |
| 2,7. |
| 2,7. | ; | ; | ; | ; | ; | |
B*50. | 0,012. |
| 2,4. |
| 3,4. | ; | ; | ; | ; | ; | |
B*58. | 0,003. |
| 2,4. |
| 2,6. | ; | ; | ; | ; | ; | |
Cw*04. | 0,05. |
| 1,5. |
| ; | ; | ; | ; | ; | ; | |
DRB1*09. | 0,01. |
| 2,4. |
| 3,3. | ; | ; | ; | ; | ; | |
DRB1*14. | 0,002. |
| 2,5. |
| 4,5. | ; | ; | ; | ; | ; | |
В*13. | ; | ; | ; | ; | ; | 0.03. |
| 0.50. I:2.0. |
| 5.6. | |
DQB1*02. | ; | ; | ; | ; | ; | 0.007. |
| 0.6. In:1.6. |
| 13.8. | |
p — уровень достоверности; OR— отношение шансов, CI— доверительный интервал;
EF/PF — этиологическая /превентивная фракция.
Характер распределения частот встречаемости генов HLAсистемы у детей с ОМЛ.
Были исследованы 146 детей, больных ОМЛ, (средний возраст составил 8,9 лет ± 5,2), по этническим признакам относящиеся к популяции европеоидов и разделенные на группы: ОМЛ М2 (28 детей), ОМЛ М4 (26 детей), ОМЛ М5 (28 детей) и ОМЛ М7 (18 детей). Дети с М0, М1и М6 вариантами в исследование не были включены из-за их малочисленности (всего 14 детей). Исследования по выявлению HLA-ассоциированных генов с вариантом промиелоцитарного лейкоза (М3) не проводились, так как типирование антигенов гистосовместимости у них не осуществлялось. У 32 детей больных ОМЛ морфологические варианты не были выявлены. Из-за малочисленности группы больных ОМЛ статистическая обработка результатов HLA-типирования в зависимости от пола не проводилась.
В результате проведенных исследований (рис. 8−11) у больных детей с ОМЛ были обнаружены достоверные отклонения от нормального распределения HLA-генов.
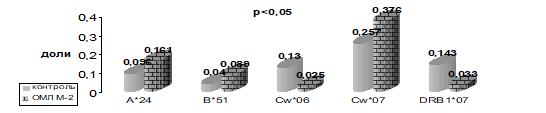
Рисунок 8 Частота встречаемости HLA-специфичностей у детей, больных ОМЛ М-2.

Рисунок 9. Частота встречаемости HLA-специфичностей у детей, больных ОМЛ М-4.
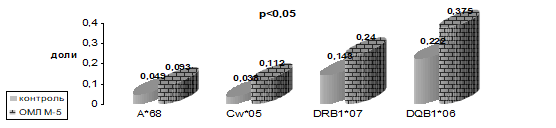
Рисунок 10. Частота встречаемости HLA-специфичностей у детей, больных ОМЛ М5.
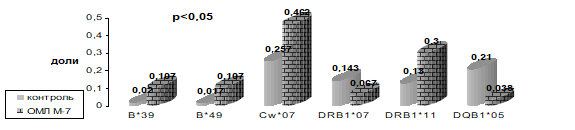
Рисунок 11. Частота встречаемости HLA-специфичностей у детей, больных ОМЛ М7.
Таким образом, можно заключить, что различные морфологические варианты ОМЛ имеют многообразные иммуногенетические маркеры предрасположенности и устойчивости к этому заболеванию.
С целью выявления «общего маркера» для миелобастного лейкоза была исследована общая группа всех больных детей (146 пациентов) с ОМЛ, независимо от варианта, а также пола и возраста ребенка (табл. 12). Из них было 88 мальчиков и 58 девочек. Был обнаружен целый ряд аллелей HLA-генов с достоверно аномальным их распределением у детей, больных ОМЛ, по сравнению с контрольной группой у здоровых детей. Это специфичности относящиеся, как к классу I — A*24, A*68, C*05, Cw*07, так и к классу II — DRB1*11, DRB1*07, DQB1*02.
Таблица 12. Иммуногенетические факторы предрасположенности и устойчивости к развитию ОМЛ у детей (n=146).
HLA-специфичности. | Маркеры риска. | Маркеры устойчивости. | |||||||
р | OR. | CI. | EF,%. | р | OR. | CI. | PF,%. | ||
A*24. | 0,02. | 1,820. | 1,08−2,41. | ; | ; | ; | ; | ; | |
A*68. | 0,04. | 1,8. | 1,06−3,06. | ; | ; | ; | ; | ; | |
Cw*05. | 0,05. | 2,2. | 1,257−4,089. | 7,8. | ; | ; | ; | ; | |
Cw*07. | 0,0001. | 2,1. | 1,45−3,22. | 35,5. | ; | ; | ; | ; | |
DRB1*11. | 0,05. | 1,5. | 1,02−2,08. | ; | ; | ; | ; | ; | |
DRB1*07. | ; | ; | ; | ; | 0,001. | 0,6-In:1,7. | 0,36−0,88. | 11,0. | |
DRQB1*02. | ; | ; | ; | ; | 0,03. | 0,6 In:1,7. | 0,41−0,93. | 15,0. | |
p — уровень достоверности; OR (odds ratio) — отношение шансов; CI (confidence interval) — доверительный интервал, EF/PF — этиологическая /превентивная фракция Следовательно, специфичности Cw*05 и HLA-Cw*07 являются маркерами риска развития ОМЛ у детей, а HLA-DRB1*07 — маркером устойчивости к этому заболеванию у детей. Причем специфичность Сw*07 имеет высокой силы ассоциацию и предрасположенность к заболеванию ОМЛ у детей.
Таким образом, примененная стратегия для HLA-типировании образцов пуповинной крови двумя методами — SSO и SSPпозволяет получать достоверные и однозначные результаты. Проведенный анализ результатов исследований выявил характерный профиль распределения специфических аллелей системы HLA у населения московского региона, соответствующий европеоидам. Результаты сопоставления группы сравнения (здоровое население) и основной группы (дети, больные острыми лейкозами) показали, что полученные данные могут быть использованы при изучении различных заболеваний, ассоциированных с HLA-системой и в популяционных исследованиях.
Научно-обоснованный алгоритм банкирования пуповинной крови с применением высокотехнологичных и молекулярно генетических методов для трансплантаций в восстановительной медицине
Для дальнейшего развития клеточного направления восстановительной медицины — банки ПК, имеющие регистр неродственных доноров, должны быть инспектированы и аккредитированы в соответствующих органах контроля. Необходима ясная политика в отношении селекции доноров ПК, скрининга материала и его тестирования. Трансплантационные центры должны предоставлять полную информацию о проведенной процедуре трансплантации, анализ которой позволит гарантировать безопасность и эффективность материала.
В соответствии со стандартами GMP (Good manufacture practice — надлежащая производственная практика) скрининг здоровья матерей, получение добровольного информированного согласия матери; сбор и транспортировка ПК; обработка, криозамораживание, хранение и мониторинг образцов ПК; маркировка и этикетирование на всех этапах работы; тестирование на стерильность, иммуногенетику, правила извещения в случае обнаружения возбудителей гемотрансмиссивных инфекций в соответствии с законодательством; критерии изъятия из криохранилища и выдачи образцов ПК, включая некондиционные образцы, а также правила транспортировки в трансплантационные центры; управление контролем качества, включая правила действия при обнаружении нарушений; управление информационными ресурсами, включая критерии поиска, сравнения показателей донора и потенциального реципиента и отбора образцов пуповинной крови для трансплантаций; процедуры получения и анализа результатов проведенных трансплантаций; документация по обучению персонала и поддержанию уровня его квалификации; управление ресурсами оборудования, включая поставки расходных материалов, сервисное обслуживание, санитарную обработку, утилизацию и дезинфекцию, действия в аварийных и непредвиденных ситуациях является минимально необходимым набором технологических инструкций, используемых при банкировании ПК.
С 2003 г. по 2010 г. в ГУЗ «БСК ДЗМ» было обработано 7010 единиц ПК, заложено на хранение 3964 единиц. За период с 2008 г. по май 2010 г. для проведения трансплантации ГУЗ «БСК ДЗМ» было выдано 59 единицы пуповинной крови, что составило 1,5% от всех образцов находящихся на хранении. Этот показатель ниже, чем сообщается в международных исследованиях. Одной из причин столь низкого процента выданных банком (ГУЗ «БСК ДЗМ») образцов ПК является низкая трансплантационная активность в России, что связано как с недостаточным количеством специализированных клиник, так и низким числом ежегодно производимых трансплантаций.
На этапе HLA-типирования возникает ряд сложностей, связанных с организацией этого процесса на большом массиве биоматериала и ограниченным объемом крови каждого образца. В настоящей работе была представлена оптимальная модель для разрешения этой проблемы.
Качество и эффективность производимой продукции является одним из важнейших факторов успешного банкирования и строится на основе принципа 100% контроля материала и системном подходе к технологическому процессу.
Таким образом, внедрение результатов проведенного исследования позволило создать научно-обоснованный алгоритм банкирования пуповинной крови и оптимизировать высокотехнологичные методы подготовки эффективного качественного трансплантационного материала для использования целях трансплантации и повышения регуляторных, компенсаторных и адаптивных механизмов организма.
Проведенная оценка эффективности процедуры лейкоконцентрации при различных особенностях течения беременности родов и технологических этапов сбора ПК позволила выработать алгоритм отбора образцов ПК для проведения процедуры автоматической концентрации или выделения ГСК методом двойного центрифугирования.
На основании результатов исследования клеточного состава ПК при помощи автоматического анализатора клеток крови и микроскопии окрашенных мазков, получены его референтные значения и степень расхождения значений, что позволило оптимизировать методику расчетов клеточности. Для оценки эффективности лейкоконцентрата ГСК ПК необходимо проводить определение уровня спонтанного апоптоза лейкоцитов в ПК, общего количества, жизнеспособности и эффективности КОЕ.
Таким образом, анализ результатов проведенного исследования позволил разработать и внедрить научно-обоснованный алгоритм оптимизации процесса банкирования пуповинной крови с применением высокотехнологичных и молекулярно-генетических методов для получения эффективного и безопасного клеточного материала для трансплантаций в восстановительной медицине.