Вольтамперометрический метод анализа

Поверхность ртути, как любого металла, в растворе заряжена. При разомкнутой цепи ртуть заряжена положительно. При увеличении потенциала положительный заряд уменьшается, достигает нуля (точка нулевого заряда) при потенциале, зависящем от природы аниона фона, и затем ртуть заряжается отрицательно. Это выражается так называемой электрокапиллярной кривой. Заряд образующегося молекулярного… Читать ещё >
Вольтамперометрический метод анализа (реферат, курсовая, диплом, контрольная)
Вольтамперометрия — электрохимический метод анализа, основанный на изучении зависимости тока, протекающего через электролитическую ячейку, от напряжения. Она является качественным и количественным методом анализа.
Вольтамперометрия — высокочувствительный и экспрессный метод определения неорганических и органических веществ, пригодный для анализа химических, геохимических, биохимических, медицинских, фармацевтических и других объектов. Это один из наиболее универсальных методов определения следовых количеств веществ, он позволяет одновременного определять несколько компонентов (в оптимальных условиях эксперимента — до четырех-пяти), а также имеет линейную зависимость тока от концентрации в диапазоне 10-8—10~2 М.
Первым из многочисленных вольтамперометрических методов был метод полярографии, который в 1922 г. разработал Я. Гейровский (J. Heyrovsky — чешский химик, 1890—1967). Суть метода состоит в том, что используют постоянно обновляющийся электрод (ртутную каплю) и снимают зависимость тока от напряжения.
По решению Международного союза по теоретической и прикладной химии (IUPAC) термин «вольтамперометрия» было решено использовать в качестве обобщающего, а термин «полярография» сохранить только для частного случая — применения ртутного электрода с обновляемой поверхностью.
Полярография. Рассмотрим принцип полярографии для случая, когда в растворе находятся ионы металлов, которые электролитически восстанавливаются на ртутном катоде. В этот раствор (рис. 4.23, а) опускают два электрода. Один — капля ртути (катод), периодически вытекающая из капилляра, такой электрод называют капающим ртутным. Другой — слой ртути с большой поверхностью на дне ячейки (анод). Электроды соединяют с источником постоянного тока и постепенно повышают напряжение Е со скоростью 2—5 мВ/e, фиксируя изменение силы тока I.
Для обеспечения достаточно высокой электропроводности в ячейку добавляют 0,05—1 М раствор индифферентного электролита (фона). Обычно можно пренебречь током, протекающим через двойной слой ячейки, поэтому.

Это означает, что вид подпрограммы определяется только величиной сопротивления капающего ртутного электрода Яэя.
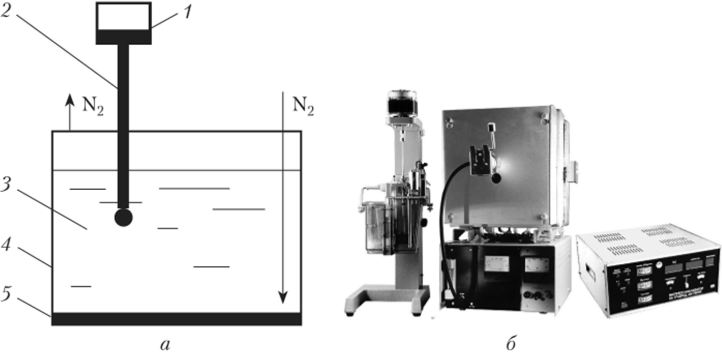
Рис. 4.23. Полярограф:
а — полярографическая ячейка: 1 — сосуд с ртутью; 2 — капилляр;
3 — анализируемый раствор; 4 — корпус ячейки; 5 — донная ртуть (анод); б — внешний вид универсального полярографа Капающий ртутный электрод обладает следующими качествами:
- • строгое чередование зарождения, роста и отрыва капель обеспечивают хорошую воспроизводимость площади поверхности и постоянное ее обновление, поэтому воспроизводимость подпрограмм практически абсолютная;
- • электрод является почти идеально поляризуемым в очень широком интервале потенциалов, ограниченном в анодной области электродными реакциями окисления ртути (+0,4 В в кислой и 0,006 В в щелочной среде), а в катодной — реакциями восстановления иона Н+ (от -1 до -1,5 В в зависимости от концентрации кислоты) или катиона фонового электролита (от -2 В для ионов щелочных металлов до -2,5 В для R/, N+). Это позволяет изучать и определять вещества, восстанавливающиеся при очень высоких отрицательных потенциалах, что невозможно на электродах из иных материалов;
- • многие металлы после своего восстановления образуют амальгамы, т. е. накапливаются в ртути, а не остаются на ее поверхности.
При проведении полярографического анализа требуется соблюдение следующих условий:
- • для поддержания необходимой УЭП анализируемого раствора в него вводят фоновый электролит, например хлорид или нитрат калия, хлорид аммония и др. Концентрация фонового электролита должна быть выше концентрации полярографически активного вещества в оптимальном случае не менее чем в 100 раз. При этом концентрация самого полярографически активного вещества обычно лежит в пределах от 10-5 до 102 моль/л;
- • необходимо термостатировать полярографическую ячейку, поддерживая температуру постоянной с погрешностью ±0,5°С;
- • перед проведением полярографического анализа из анализируемого раствора удаляют растворенный в нем кислород, для чего пропускают инертный газ (азот) в течение 15 мин.
Схема полярографической установки для регистрации подпрограмм показана на рис. 4.24. Электролитическую ячейку ЭЯ включают в цепь, состоящую из источника постоянного напряжения Е, калиброванного сопротивления АБ, вольтметра V и устройства для регистрации тока Г. Перемещая движок С вдоль реостата АБ, на электролитическую ячейку подают напряжение от внешнего источника Е и регистрируют протекающий через нее ток.
Раздельные волны на полярограмме получаются при АЕи2 >0,1 В, если концентрации компонентов смеси равны. При других соотношениях концентраций необходима еще большая разность потенциалов полуволн. Род вещества соответствует напряжению полуволны, а его концентрация — высоте волны Д/.
Классическая полярограмма в идеализированном виде изображена на рис. 4.25. Ее характеристиками являются: сила предельного диффузионного тока ID, мкА (или пропорциональная величина — высота волны, мм), потенциал в точке максимального наклона участка Б—В (I = ID/2), называемой потенциалом полуволны Е{/2, В, и наклон восходящего участка Б—В.
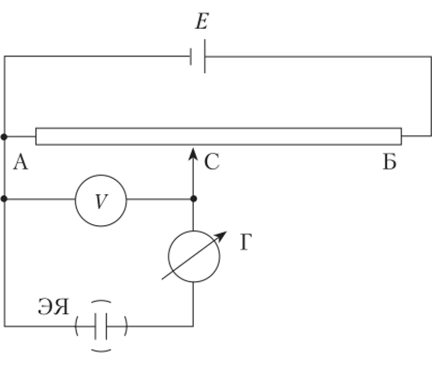
Рис. 4.24. Схема полярографической установки:
ЭЯ — электролитическая ячейка; Е — источник постоянного напряжения; АБ — калиброванное сопротивление; С — движок; V — вольтметр;
Г — устройство для регистрации тока.
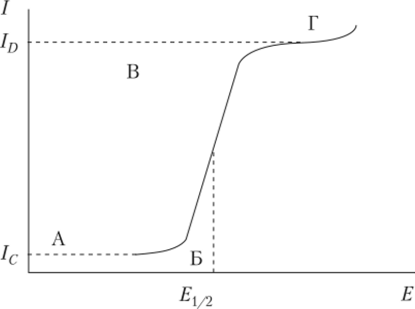
Рис. 4.25. Классическая подпрограмма:
1С — остаточный ток; ID — диффузионный ток Как следует из рис. 4.25, подпрограмма состоит из трех участков: пологого А—Б, Б—В, характеризующегося резким подъемом тока за счет электрохимической реакции, и, наконец, Б—Г, соответствующего установлению практически постоянного значения тока. Подъем тока в точке Г обусловлен новой электрохимической реакцией. Рассмотрим каждый из этих участков подробнее.
На начальном участке А—Б ток с изменением потенциала меняется очень слабо. Это означает, что до начала электрохимической реакции (точка Б) ртутный электрод является почти идеально поляризуемым. Небольшой ток, протекающий на начальном участке подпрограммы, называют остаточным. Основной вклад в него вносит формирование двойного электрического слоя — конденсатора (см. параграф 4.1).
Поверхность ртути, как любого металла, в растворе заряжена. При разомкнутой цепи ртуть заряжена положительно. При увеличении потенциала положительный заряд уменьшается, достигает нуля (точка нулевого заряда) при потенциале, зависящем от природы аниона фона, и затем ртуть заряжается отрицательно. Это выражается так называемой электрокапиллярной кривой. Заряд образующегося молекулярного конденсатора q определяется соотношением.

где q — заряд; Е — потенциал; С — емкость конденсатора.
Расстояние между «пластинами» (одна — поверхность ртутного капельного электрода, другая — плоскость, проходящая через центры ближайших к нему ионов) составляет порядка 0,1 нм, поэтому емкость конденсатора достаточно велика.
Процесс формирования и заряжения конденсатора повторяется на каждой капле, поэтому протекает небольшой, но устойчивый ток заряжения (емкостный ток 1С)

С учетом изменения поверхности капли S имеем.
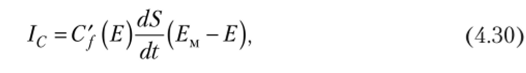
где Ем — точка нулевого заряда; C’j (E) — емкость, отнесенная к единице поверхности.
Вторым слагаемым остаточного тока является ток, обусловленный восстановлением электроактивных примесей, чаще всего плохо удаленного кислорода. Остаточный ток не связан с концентрацией определяемого вещества, поэтому его желательно уменьшить. Вклад, вносимый электроактивными примесями, снижают, применяя чистые реактивы и воду. Однако ток заряжения 1С в условиях классической полярографии снизить нельзя, и это ограничивает ее возможности.
При достижении точки Б (потенциал выделения) начинается электрохимическая реакция. С этого момента рост тока опережает рост потенциала электрода — электрод деполяризуется. Поэтому вещество, участвующее в электрохимической реакции, называют деполяризатором.
В итоге предельный ток определяется только диффузией деполяризатора из объема раствора в обедненный приэлектродный слой, поэтому его называет диффузионным, 1п. Он пропорционален концентрации деполяризатора в растворе С (уравнение Ильковича).


где п — число электронов, принимающих участие в электродной окислительно-восстановительной реакции; D — коэффициент диффузии восстанавливающего вещества; т — масса ртути, вытекающей из капилляра в секунду; т — время образования капли ртути при потенциале полуволны (3—5 с).
Масса ртути т и время каплеобразования т зависят от характеристик ртутного капающего электрода и высоты столбика ртути.
Стеклянный капилляр ртутного капающего микроэлектрода обычно имеет внешний диаметр 3—7 мм, внутренний — 0,03—0,05 мм, длину — 6—15 см. Высота ртутного столбика от нижнего конца капилляра до верхнего уровня поверхности ртути в резервуаре обычно составляет 40—80 см.
Уравнения (4.28)—(4.32) справедливы для классической полярографии, когда скорость развертки потенциала не превышает 2—5 мВ/e и электродный процесс обусловлен только диффузией и протекает обратимо.
Ток, протекающий через ячейку, является суммой фарадеевского (аналитический, полезный сигнал) /ф и емкостного (помеха) 1С токов.
Соотношение /ф//с можно улучшить за счет увеличения /ф, уменьшения /с и, наконец, разделения /ф и 1С. Эти возможности реализуются в осциллографической полярографии и инверсионной вольтамперометрии (увеличение /ф), импульсной и квадратно-волновой переменнотоковой полярографии (уменьшение 1С) и полярографии на синусоидальном переменном токе (разделение /фИ/С).
Если в анализируемом растворе присутствует несколько восстанавливающихся веществ, причем разность между значениями их потенциал о is полуволны составляет не менее 0,2 В, то на полярограмме наблюдается несколько волн, каждая из которых отвечает тому или иному восстанавливающемуся веществу (интегральная, классическая полярограмма — рис. 4.26, а, дифференциальная полярограмма — рис. 4.26, б). Уже при разности потенциалов пиков порядка 0,02—0,05 В на дифференциальной полярограмме можно наблюдать раздельные пики вместо суммарной волны на интегральной полярограмме. Поэтому она более чувствительная, чем интегральная.
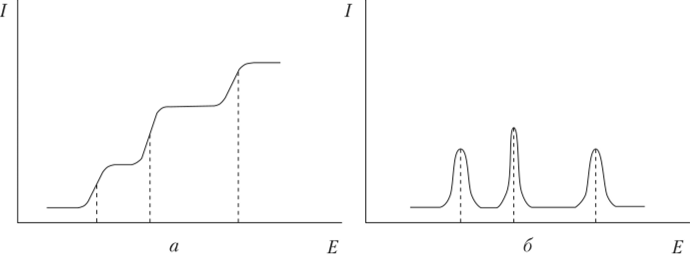
Рис. 4.26. Классическая полярограмма трех веществ:
а — интегральная; б — дифференциальная
Значения потенциала полуволны ?½ некоторых катионов металлов (относительно потенциала насыщенного каломельного электрода) приведены в табл. 4.1.
Таблица 4.1
Значения потенциала полуволны Еу2 некоторых металлов.
Электродная реакция. | E{/2y В. | Фоновый электролит (состав фона). |
As3+ + Зе = As. | — 0,7. | 1 моль/л H2S04 + 0,01% желатина. |
Cd2+ + 2е = Cd. | — 0,60. | 0,1 моль/л НС1. |
Cd2+ + 2е = Cd. | — 0,79. | 6 моль/л НС1. |
Со2+ + 2е = Со. | — 1,03. | 1 моль/л KSCN. |
Си2+ + 2е = Си. | 0,5 моль/л H2S04 + 0,01% желатина. | |
Си2+ + 2с = Си. | — 0,38. | 1 моль/л Na2C4H4Oe, pH = 12. |
Fe2+ + 2е = Fe. | — 1,37. | 1 моль/л НСЮ4, pH = 0−2. |
Мп2+ + 2с = Мп. | — 1,54. | 0,5 моль/л NH3 + 0,5 моль/л NH4C1. |
Ni2+ + 2е = Ni. | — 1,1. | НС104, pH = 0−2, 1 моль/л КС1. |
Ni2+ + 2е = Ni. | — 1,06. | 1 моль/л N1I3 + 0,2 моль/л NII4C1 + 0,005% желатина. |
Zn2+ + 2е = Zn. | — 1,02. | 1 моль/л КС1. |
Zn2+ + 2e = Zn. | — 1,33. | 1 моль/л NH3 + 0,2 моль/л NH4C1 + 0,005% желатина. |
Zn2+ + 2e = Zn. | — 1,49. | 1 моль/л NaOH. |
Развитие классической полярографии привело к созданию следующих методов.