Способы выражения состава растворов

Молялъностъ — отношение количества растворенного вещества В (моль) к массе т (кг) растворителя Y,. Например, молярная концентрация раствора, в 250 мл которого содержится 0,25 г серной кислоты: Например, моляльная концентрация раствора, приготовленного из 2 г КОН и 200 г Н20, равна. Раствор, в 1 л которого содержится 1 моль эквивалента вещества, называется нормальным. Массовая доля — отношение… Читать ещё >
Способы выражения состава растворов (реферат, курсовая, диплом, контрольная)
Наиболее употребимы следующие способы выражения состава растворов.
Молярная концентрация — отношение количества вещества В (моль), содержащегося в растворе, к объему этого раствора (л):

где т{В) — масса растворенного вещества В, г; М (В) — молярная масса вещества В, г/моль; V— объем раствора, мл; 1000 — коэффициент перевода миллилитров в литры. Отношение т (В)/М (В) дает количество растворенного вещества (моль).
Например, молярная концентрация раствора, в 250 мл которого содержится 0,25 г серной кислоты:

Вместо обозначения моль/л допускается обозначение М (например, 0,01 М раствор).
Молярная концентрация эквивалента — отношение количества вещества эквивалента (моль), содержащегося в растворе, к объему этого раствора (л).
Уравнение для расчета молярной концентрации эквивалента аналогично уравнению (6.1) с той разницей, что вместо молярной массы вещества записывают молярную массу эквивалента, равную произведению фактора эквивалентности и молярной массы вещества:

Например, молярную концентрацию эквивалента фосфорной кислоты в растворе, 100 мл которого содержат 3,27 г Н3РО4, при условии полной нейтрализации можно вычислить следующим образом. В реакции полной нейтрализации участвуют все три катиона водорода каждой молекулы кислоты:

поэтому ее эквивалент в этой реакции — условная частица, 1/3 молекулы Н3РО4. Фактор эквивалентности равен 1/3, а молярная масса эквивалента — 1/3 молярной массы фосфорной кислоты: М{ 1/ЗН3РО4) = 1/ЗМ (Н3Р04). Исходя из этого, молярная концентрация эквивалента фосфорной кислоты будет равна.

Для обозначения размерности молярной концентрации эквивалента вместо моль/л допускается использовать сокращение н. (в рассматриваемом примере речь идет об 1 н. растворе фосфорной кислоты).
Раствор, в 1 л которого содержится 1 моль эквивалента вещества, называется нормальным.
Массовая доля — отношение массы растворенного вещества к общей массе раствора:

где от (В) — масса растворенного вещества; от (р) — масса раствора.
В отличие от молярной концентрации массовая доля — безразмерная величина. Ее можно выражать в долях единицы. Например, если в 200 г раствора содержится 4 г сульфата калия, то массовая доля этого вещества равна.

Массовую долю можно выражать и в процентах. Например, если в 1000 г раствора содержится 12 г хлорида натрия, то массовая доля (%) этого вещества равна.
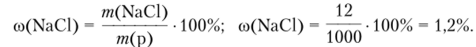
В очень разбавленных растворах массовую долю растворенного вещества выражают в тысячных долях, которые пазывают промилле и обозначают %о, и в миллионных долях, которые обозначают млн-1.
Масса раствора складывается из масс одного или нескольких растворенных веществ и массы растворителя, поэтому для расчета массовой доли растворенного вещества можно воспользоваться уравнением.

Например, массовую долю (%) иода в растворе, приготовленном из 10,6 г иода и 200 г этанола, можно рассчитать при помощи уравнения.

Если известны объем раствора и его плотность, то массовую долю растворенного вещества можно рассчитать, пользуясь уравнением.

где V — объем раствора, мл; р — плотность раствора, г/мл.
Молялъностъ — отношение количества растворенного вещества В (моль) к массе т (кг) растворителя Y,.

Например, моляльная концентрация раствора, приготовленного из 2 г КОН и 200 г Н20, равна.

Титр — отношение массы (г) растворенного вещества В к объему раствора V (мл):

Например, титр раствора, 100 мл которого содержат 5 г Na2C03, равен 