Второе и третье начала термодинамики

Для определения изменения энтропии в процессе реакции при стандартных состояниях реагентов и температуре 298 К пользуются величинами стандартных энтропий веществ (52!)s), приведенными в справочниках. Размерность стандартной энтропии веществ ДжДмоль • К). Где 5 — энтропия; k — константа Больцмана (k = = 1,38 • 10 23 Дж/К); W — термодинамическая вероятность существования системы, т. е. число… Читать ещё >
Второе и третье начала термодинамики (реферат, курсовая, диплом, контрольная)
История развития термодинамики такова, что второе начало было сформулировано ранее первого. Исходная формулировка второго начала невозможен вечный двигатель второго рода, т. е. устройство, в котором все количество теплоты, выделяемой системой, превращается в механическую работу. Возможно лишь частичное превращение теплоты в работу (в противоположность обратному процессу). В 1865 г. Р. Ю. Клаузиус сформулировал второе начало термодинамики следующим образом: для любой равновесной термодинамической системы существует однозначная функция состояния, являющаяся мерой ее неупорядоченности, называемая энтропией (S), изменение которой связано с поглощенной системой теплотой следующим соотношением:
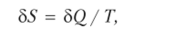
где Q — переданное системе количество теплоты; Т — абсолютная термодинамическая температура.
Энтропия (5) характеризует направление протекания теплообмена между системой и внешней средой, а также направление самопроизвольных процессов в изолированной системе, т. е. в системе, в которой внутренняя энергия остается постоянной при любых изменениях. В таких системах самопроизвольно могут протекать только процессы, характеризующиеся увеличением энтропии (AS > 0) с уменьшением упорядоченности системы.
Это заключение вытекает из уравнения Больцмана, описывающего связь энтропии с термодинамической вероятностью существования системы (W), т. е. с числом характеризующих ее микросостояний (положением частиц в пространстве, их энергией, скоростью и направлением перемещения в веществе и т. п.). Одно макросостояние, характеризующееся температурой, давлением и объемом, может осуществляться огромным числом микросостояний W. Уравнение Больцмана:
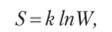
где 5 — энтропия; k — константа Больцмана (k = = 1,38 • 10 23 Дж/К); W — термодинамическая вероятность существования системы, т. е. число возможных микросостояний атомов или молекул в системе без изменения ее внутренней энергии.
Согласно этому уравнению, изменение энтропии системы можно выразить следующим образом:
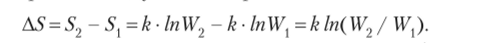
В самопроизвольно протекающих процессах более упорядоченные системы переходят в менее упорядоченные, т. е.
> Wv отсюда In (W2 /) > 0, следовательно, и AS > 0.
Энтропия является величиной, характеризующей меру (степень) неупорядоченности системы. Она возрастает с увеличением движения частиц, т. е. при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т. п. Процессы конденсации, кристаллизации, сжатия, упрочнения связей, полимеризации, связанные с увеличением упорядоченности системы, ведут к уменьшению энтропии.
В отличие от других термодинамических функций, можно определить не только изменение, но и абсолютное значение энтропии. Это вытекает из постулата М. Планка (1911 г.), согласно которому «при абсолютном нуле температуры энтропия идеального кристалла равна нулю». Этот постулат получил название третьего закона термодинамики. Значения энтропии веществ, отсчитанные от этого уровня, называются абсолютными и приводятся в справочниках термодинамических свойств веществ.
Так как энтропия является функцией состояния системы, то ее изменение при протекании химических реакций (по аналогии с энтальпией) может быть выражено следующим образом: 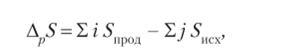
где i и j — стехиометрические коэффициенты в уравнении реакции.
Таким образом, изменение энтропии системы в результате протекания химической реакции равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов.
Для определения изменения энтропии в процессе реакции при стандартных состояниях реагентов и температуре 298 К пользуются величинами стандартных энтропий веществ (52!)s), приведенными в справочниках. Размерность стандартной энтропии веществ ДжДмоль • К).
Пример 5.2. Вычислим изменение энтропии в газообразной системе в результате протекания реакции:
CH4(|.) + H20®=CO(i.) + 3H2(i) при 298 К и постоянном давлении.
Решение.
По таблице стандартных энтропий веществ находим, что 5*0,298= = 197,54 ДжДмоль • К), 5^2 298 = 130,58 ДжДмоль • К), 5*н4, 298 = = 186,19 ДжДмоль • К) и 5{^0 298 = 188,7 ДжДмоль • К). Используя уравнение, производим вычисления:
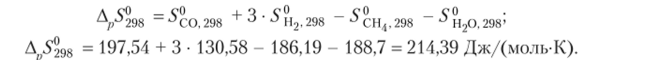
Энтропия химической реакции при других значениях температуры (7' Ф 298 К) вычисляется с учетом зависимостей теплоемкостей исходных веществ и продуктов реакции (АСр) от температуры по следующей формуле:
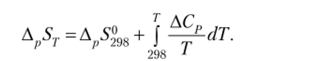
При практических расчетах принимают следующие степени приближения:
- • пренебрегают температурной зависимостью стандартной энтропии химической реакции и считают ApST = Д 5^98= = const;
- • принимают АСр = ДС®298 = const Для данной химической реакции.
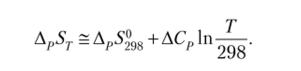
В этом случае влияние температуры на энтропию химической реакции может быть оценено по следующему уравнению: