Энергия Гиббса и энергия Гельмгольца

По аналогии с другими функциями состояния системы энергию Гиббса (Гельмгольца) химической реакции можно рассчитать как сумму энергий Гиббса (Гельмгольца) образования продуктов реакции за вычетом суммы энергий Гиббса (Гельмгольца) образования исходных веществ с учетом стехиометрических коэффициентов: Если АН > 0 и AS > 0, то возможны два варианта: при температурах, близких к абсолютному нулю, Гдя… Читать ещё >
Энергия Гиббса и энергия Гельмгольца (реферат, курсовая, диплом, контрольная)
Используя связь количества теплоты для равновесных процессов с изменением энтропии, первое начало термодинамики можно записать в виде:
• для изобарно-изотермического процесса (т.е. процесса при постоянных температуре и давлении):
или 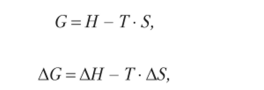
где G — энергия Гиббса, измеряемая в кДж/моль.
Поскольку энергия Гиббса определяет часть энергетического эффекта химической реакции, которую можно превратить в работу, то ее называют свободной энергией. Энтропийный фактор (Г• Д5), представляющий собой часть энергетического эффекта, которую невозможно превратить в работу, называют связанной энергией;
• для изохорно-изотермического процесса (т.е. процесса при постоянной температуре и объеме системы):
или 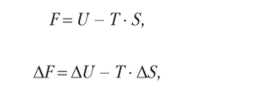
где F — энергия Гельмгольца, измеряемая в кДж/моль.
Энергия Гиббса (G) и энергия Гельмгольца (Г) суммируют энтальпийный и энтропийный факторы и являются критериями самопроизвольно протекающих изобарноизотермических и изохорно-изотермических процессов соответственно. Зная численные значения АН и AS, можно рассчитать величины AG и AF, а по полученным данным предсказать возможность или невозможность самопроизвольного протекания реакции и оценить влияние температуры на ход этого процесса.
В изобарно-изотермических условиях самопроизвольно протекают процессы с уменьшением энергии Гиббса (AG < 0), а в изохорно-изотермических — энергии Гельмгольца (АГ < 0);
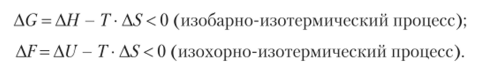
Отсюда для изобарно-изотермических процессов: если ДЯ < 0 и AS > 0, то имеет место самопроизвольный процесс; если АН > 0 и AS < 0, то самопроизвольный процесс невозможен.
Если АН > 0 и AS > 0, то возможны два варианта: при температурах, близких к абсолютному нулю, Гдя| > | Т ? Д5| и ДС > 0 самопроизвольный процесс невозможен; при высоких температурах | АН < Т ? AS | и AG < 0 и имеет место сам о п ро из вол ь н ы й п роцесс.
Если АН < 0 и AS < 0, то также возможны два варианта: при температурах, близких к абсолютному нулю, [дя| < I Т ? ДД| и AG < 0; и имеет место самопроизвольный процесс.
При высоких температурах | ДЯ| > | Т ? AS и AG > 0 самопроизвольный процесс невозможен.
При изменении независимых параметров состояния системы равновесие в изобарно-изотермических процессах достигается при AG = 0, а в изохорно-изотермических — при AF = 0.
Это заключение можно использовать для определения температуры, при которой происходит смена знака AG. При достижении равновесия вышеуказанное уравнение приобретает вид 0 = АН — Т • AS. Отсюда.
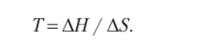
Изменение энергии Гиббса (Гельмгольца) системы при образовании 1 моль какого-либо соединения из простых веществ, устойчивых при 298 К, называется энергией Гиббса (Гельмгольца) образования данного соединения и обозначается Д, СВ (A, FR). Энергия Гиббса (Гельмгольца) образования простых веществ, например N2, 02 и т. п., принимается равной нулю. Если данное соединение и исходные простые вещества находятся в стандартных состояниях, то энергия Гиббса (Гельмгольца) образования называется стандартной энергией Гиббса (Гельмгольца) образования данного соединения и обозначается AfGR 298 {AfF 2Я8). Эти величины для многих веществ можно найти в справочниках.
По аналогии с другими функциями состояния системы энергию Гиббса (Гельмгольца) химической реакции можно рассчитать как сумму энергий Гиббса (Гельмгольца) образования продуктов реакции за вычетом суммы энергий Гиббса (Гельмгольца) образования исходных веществ с учетом стехиометрических коэффициентов:
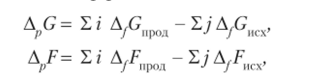
где i wj — стехиометрические коэффициенты в уравнении реакции.
Если исходные вещества и продукты реакции находятся в стандартных состояниях, то энергия Гиббса (Гельмгольца) называется стандартной энергией Гиббса (Гельмгольца) химической реакции и обозначается А^С^ (ДД>8);
Зависимость энергии Гиббса (ApGj) от температуры выражается уравнением, получившим название изотермы Вант-Гоффа, которое для реакции.
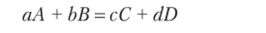
записывается в виде или 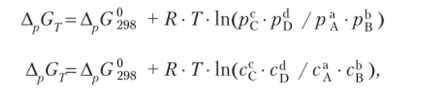
где R — универсальная газовая постоянная; Т — температура в градусах по шкале Кельвина; рс, pD, рА, рв — относительные парциальные давления соответствующих веществ; сс, cD, сА, св — концентрации соответствующих растворенных веществ (для концентрированных растворов вместо концентраций подставляются значения активности).
Если рс = Рц = рА = рв = 1 или Сс = Сц = Сд = св = 1 моль/л, ТО Д/; = Д/;298;
Учитывая, что R = 8,31 ДжДмоль • К) и In = 2,3 lg, получаем при 298 К:
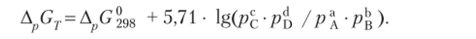
Пример 5.3. Возможно ли самопроизвольное протекание реакции 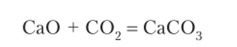
при стандартных состояниях этих веществ при температурах 298 К (25°С) и > 1110 К?
Решение.
Определим величины изменения энтальпии и энтропии реакции при температуре 298 К:
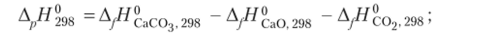
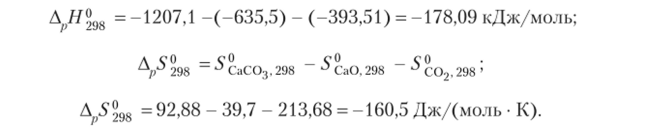
Соответственно величина энергии Гиббса равна.
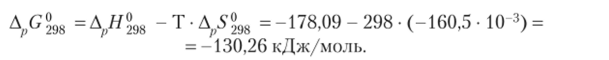
Так как величина Д G°98 < 0> то реакция при температуре 298 К протекает самопроизвольно.
Для определения температуры, при которой меняется знак энергии Гиббса, г. е. в данном случае Д^С298 станет больше нуля, воспользуемся уравнением, выведенным для условия равновесия:
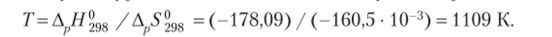
Таким образом, при температуре большей 1110 К реакция самопроизвольно не протекает.
Величины стандартных значений энтальпий образования, энергий Гиббса и энтропий некоторых веществ приведены в табл. 5.2.
Таблица 5.2
Термодинамические характеристики некоторых веществ.
Вещество. | Л н° а1И 298. (кДж/моль). | А С®
| 9°. J 298. (Дж/моль • К). |
Д1203 (к, корунд). | — 1676,0. | — 1580,0. | 50,94. |
С (алмаз). | 1,83. | 2,85. | 2,38. |
С (графит). | 5,74. | ||
СО (г). | — 110,5. | — 137,14. | 197,54. |
СО, (г). | — 393,51. | — 394,38. | 213,68. |
СН4 (г). | — 74,85. | — 50,79. | 186,19. |
С2Н2 (г). | 226,75. | 209,2. | 200,8. |
С2Н" (г). | 52,28. | 68,11. | 219,4. |
С2Н6 (г). | — 84,68. | — 32,89. | 229,5. |
С6Н6(ж). | 49,0. | 124,5. | 172,8. |
Окончание табл. 5.2
Вещество. | а тгО п/п 298. (кДж/моль). | А Г® Ljj 298 (кДж/моль). | с 0 ° 298. (Дж/моль • К). |
СН., ОН (ж). | — 238,6. | — 166,23. | 126,8. |
С2Н5ОН (ж). | — 277,7. | — 174,76. | 160,7. |
CaCO.j (кальцит). | — 1207,1. | 1128,76. | 92,88. |
СаО (к). | — 635,5. | — 604,2. | 39,7. |
Са (ОН)9 (к). | — 986,2. | — 898,5. | 83,4. |
С12 (г). | 222,96. | ||
Fc (к). | 27,15. | ||
FeO (к). | — 263,7. | — 244,3. | 58,79. |
Fe203 (к). | — 822,16. | — 740,98. | 89,96. |
Fe304 (к). | — 1117,7. | — 1014,2. | 146,4. |
Н2 (г). | 130,58. | ||
НС1 (г). | — 92,3. | — 95,27. | 186,69. |
Н2(> (г). | — 241,82. | — 228,61. | 188,7. |
Н20 (ж). | — 285,84. | — 237,2. | 70,08. |
H2S (г). | — 20,17. | — 33,01. | 205,6. |
N, (г). | 191,5. | ||
NH:s (г). | — 46,19. | — 16,66. | 192,5. |
NH4C1 (к). | — 314,4. | — 203,0. | 94,6. |
N0 (г). | 90,37. | 86,71. | 210,62. |
N02 (г). | 33,50. | 51,8. | 240,45. |
NaCl (к). | — 410,9. | — 384,0. | 72,33. |
02 (г). | 0,00. | 0,00. | 205,04. |
РЬ02 (к). | — 276,6. | — 219,0. | 76,44. |
S (к, ромб). | 31,88. | ||
Ti (к). | 30,6. | ||
ZnO (к). | — 349,0. | — 318,2. | 43,5. |