Химия актиноидов.
Общая и неорганическая химия

При растворении металлического урана в кислотах, не обладающих окислительными свойствами, образуются ионы U4* (водн) или соответствующие комплексы. Ионы U4* (водн) довольно легко окисляются до UOf* (водн). При подщелачивании кислых растворов, содержащих уран в любом состоянии окисления, идут сложные реакции гидролиза, сопровождаемые полимеризацией, и в конечном итоге, как видно из схемы… Читать ещё >
Химия актиноидов. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
Химия актиноидов составляет громадный раздел современной неорганической химии, и здесь мы лишь кратко рассмотрим некоторые основные ее положения. Многообразие состояний окисления и соответственно многообразие возможных форм соединений и окислительно-восстановительных процессов дополняются и осложняются возможностью протекания радиационно-химических реакций, т. е. реакций, идущих под воздействием радиоактивных излучений. Например, высокоактивные препараты америция не только светятся в темноте, но и разлагают воду на радикалы Н и ОН, которые мгновенно вступают в дальнейшие взаимодействия.
Актиноиды в виде простых веществ, как и лантаноиды, представляют собой типичные металлы, плавящиеся приблизительно в той же области температур, что и лантаноиды, но несколько более тяжелые (см. табл.33.2). Эти металлы химически весьма активны, в компактном состоянии они медленно окисляются на воздухе, а в мелкораздробленном — пирофорны и легко реагируют с большинством неметаллов. С водой многие металлы реагируют с выделением водорода. Практически не взаимодействуют с водой торий и протактиний, не образующие устойчивых ионов М3+ (водн), и нептуний, хотя все потенциалы восстановления М (Ш) или M (IV) до металла отрицательны и в основном близки к соответствующим потенциалам лантаноидов. Все актиноиды растворяются в кислотах.
Характер взаимодействия актиноидов с водородом примерно такой же, как и лантаноидов. Гидриды актиноидов представляют интерес как удобные исходные материалы для дальнейших синтезов. Термическое разложение гидридов — удобный способ получения порошкообразных металлов.
Галогениды актиноидов отличаются большим разнообразием и составляют обширный класс соединений (табл. 33.3). Ихформы и свойства могут быть успешно интерпретированы на основании закономерностей, выявленных нами на примере галогенидов переходных элементов первого ряда (разд. 31.6). Так, число фторидов превосходит число любых других га;
Таблица 33.3. Важнейшие галогениды актиноидов МГал".
Элемент. | Значение n в формуле МГалл | |||
фториды. | хлориды. | бромиды. | иодиды. | |
Ас. | _. | |||
Th. | 3,4. | |||
Ра. | _. | |||
и. | 3,4,5,6. | 3,4,5,6. | 3,4. | 3,4. |
Np. | 3.4.5,6. | 3,4. | 3,4. | |
Pu. | 3,4.6. | |||
Am. | 3,4. | 2,3. | 2,3. | |
Cm. | 3,4. | |||
Bk. | 3,4. | |||
Cf. | 3.4. | 2.3. | 2,3. | |
Es. | ||||
логенидов, высшие формы представлены фторидами, а низшие — иодидами. Низшие галогениды представляют собой тугоплавкие нелетучие соединения (например, температура плавления UF3 составляет 1495, CmF3 — 1 679 °С), а высшие — летучие соединения (например, UF6 возгоняется при 56,5, NpF6 плавится при 54,9 и кипит при 55,2 °С).
Летучесть UF, сыграла важную роль в создании первых атомных бомб: американская технология отделения первой ядерной взрывчатки — изотопов «*U от основного природного изотопа u,li — была основана на различии в скорости диффузии газообразных a‘UF# и a,UF4.
Химические свойства галогенидов актиноидов также в главных чертах похожи на свойства галогенидов переходных элементов. Например, склонность к гидролизу возрастает при переходе от фторидов к йодидам и в пределах производных одного галогена — с ростом состояния окисления металла. Так, гексафториды настолько энергично гидролизуются, что в присутствии даже следов влаги разъедают стекло и разлагаются сами в результате циклического процесса:
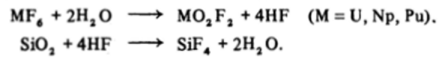
Здесь вода выступает в качестве своеобразного катализатора реакции обмена фтора на кислород между MF6 и Si02.
С жидкой водой высшие галогениды реагируют очень бурно. В частности, в случае PuF6 при этом образуются Pu02, PuF4, 02, Pu02 F2 и HF.
Химия водных растворов актиноидов особенно сложна и разнообразна. Не вдаваясь в подробности, отметим лишь самые общие ее черты. Состояния окисления +2, +3 и +4 в кислых растворах представлены аквакатионами М2* (водн), М3* (водн) и М4* (водн), подвергающимися гидролизу в соответствии с зарядом и радиусом иона. В частности, константы равновесий.

для металлов от нептуния до калифорния монотонно возрастают от 3,7 • 10″8 до 2,4 • 10″6. Состояния M (V) и M (VI) представлены в кислой среде «ильными» катионами М02 (М = Ра, U, Np, Pu, Am) и М02* (М = = U, Np, Pu, Am). В щелочной среде во всех случаях образуются соответствующие твердые гидроксиды или гидратированные оксиды.
В качестве примера остановимся несколько более подробно на химии водных растворов и состояниях окисления урана, учитывая особую практическую важность этого элемента.
Мягкий, блестящий, серого цвета металлический уран, как упоминалось выше, химически весьма активен. При нагревании на воздухе он сгорает, образуя устойчивый смешанный оксид U (IV) и U (VI) чернозеленого цвета:
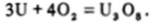
Этот же оксид получается при нагревании на воздухе U02, U03 или (NH4)2U207.
Уран непосредственно взаимодействует с азотом 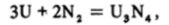 галогенами, например
галогенами, например 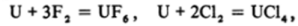 водородом
водородом 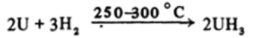
и другими неметаллами. Гидрид урана является очень удобным реактивом для синтеза многих соединений урана, например:
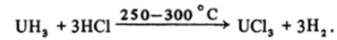
Уран образует множество комплексов, в которых он находится в различных состояниях окисления, в основном в виде U (IV), например в K2UCU или K.4[U (C204)4] 5НгО и U (VI), например в малорастворимом NaZn[U02(CH3C00)3]3 • 6Н20, применяемом для аналитического определения натрия, и в других многочисленных солях уранила 1Ю2*, например в (U02)2[Fe (CN)6], служащем для качественного определения урана.
Химия водных растворов урана также достаточно богата. Как видно из схемы его потенциалов, в кислых растворах уран может находиться в катионных формах в четырех состояниях окисления, правда, ион UvOj подвержен диспропорционированию:
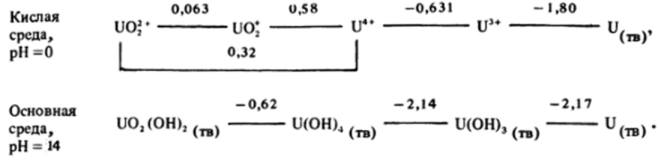
При растворении металлического урана в кислотах, не обладающих окислительными свойствами, образуются ионы U4* (водн) или соответствующие комплексы. Ионы U4* (водн) довольно легко окисляются до UOf* (водн). При подщелачивании кислых растворов, содержащих уран в любом состоянии окисления, идут сложные реакции гидролиза, сопровождаемые полимеризацией, и в конечном итоге, как видно из схемы потенциалов, образуются соответствующие нерастворимые гидроксоформы.
В целом, анализируя сложную химию элементов семейства актиноидов, можно условно и довольно приближенно разделить их на четыре подсемейства, которые мы последовательно и очень кратко рассмотрим.
1.В первое подсемейство входит единственный элемент — актиний, представляющий по химическому поведению ближайший аналог лантана. Оба элемента проявляют в соединениях единственное состояние окисления +3; ион Ас5* имеет несколько больший радиус (0,111 нм), чем Ln3* (0,106 нм), что определяет некоторые количественные различия их характеристик. Например, стандартный потенциал 2Гм*7М для як1**1®* еще чуть более отрицателен (—2,6 В), чем для лантана (—2,52 В).
Качественное отличие от лантана актинию придает его высокая радиоактивность, период полураспада аа,Ас составляет 21,7 года. Металлический актиний светится в темноте, и его радиоактивность в целом повышает его реакционную способность за счет возможности генерации активных радикальных частиц при радиолиэе окружающей его среды.
- 2. Второе подсемейство составляют торий, протактиний и уран. Эти элементы похожи на переходные металлы третьего ряда соответствующей группы — с четвертой по шестую, т. е. на гафний, тантал и вольфрам соответственно. Аналогия начинается с состояний окисления и включает химию некоторых бинарных соединений, поведение в водных растворах и образование комплексов. Однако по кристаллическим структурам ряда соединений эти элементы блюки к лантаноидам, поэтому, скажем, торий в природе встречается в основном совместно с элементами группы лантаноидов.
- 3. В третье подсемейство мы снова включим уран (пусть Вас это не смущает, здесь он выступает как родоначальник маленького подсемейства, подобно тому как полноправный член III группы дополнительной подгруппы лантан одновременно является и первым лантаноидом), а также три элемента, подобных ему: ураноиды нептуний, плутоний и америций. Эти элементы во многом похожи на уран, но наиболее характерное состояние окисления во всем подсемействе неодинаково. Оно монотонно убывает от +6 для урана до +5 для нептуния, +4 для плутония и +3 для америция. Например, растворение в азотной кислоте всех оксидов урана — U02, U308 Ш02 • 21Ю3) и 1Ю3 — дает ионы ypamma (VI) 1Ю2*; нептуhwi (V) Np02 получается в водном растворе при восстановлении соединений Np (VI) в кислых растворах таким слабым восстановителем, как нитрит натрия; плутоний окисляется до Ри4* (водн) крепкой азотной кислотой (Chno ^ 2 моль/л); растворение америция и его соединений, скажем оксида Аш02, в обычных минеральных кислотах приводит к образованию иона Ат3* (водн).
- 4. Наконец, последнее, четвертое подсемейство начинается с америция и включает все трансамерициевые элементы. Здесь наблюдается аналогия с соответствующими лантаноидами. Основное состояние окисления всех этих элементов +3, а в дополнение к нему зачастую появляются состояния, стабилизированные полузаполненной /-оболочкой: Ат (Н), аналогичный Eu (II), и Bk (lV), подобный Tb (IV). Следует отметить, что транса мерициевые элементы в целом более склонны к образованию состояния окисления +2, чем соответствующие лантаноиды.