Конденсационное образование лиофобных дисперсных систем

Где Sc — поверхность критического зародыша. Таким образом, работа образования критического зародыша равна одной трети от его поверхностной энергии; остальные две трети компенсируются работой перехода вещества дисперсной фазы в более стабильное состояние. Русановым было показано, что полученное Гиббсом выражение (VI. 15) для работы образования критического зародыша может быть положено в основу… Читать ещё >
Конденсационное образование лиофобных дисперсных систем (реферат, курсовая, диплом, контрольная)
Возникновение дисперсной системы в результате образования (и последующего роста) зародышевых частиц новой стабильной фазы возможно в любой метастабильной системе. Метастабильность, связанная с удалением от состояния устойчивого равновесия системы, может быть вызвана как отклонением в химическом составе фаз (пересыщение), так и вследствие физико-химических воздействий на систему (изменение температуры или давления).
ТЕРМОДИНАМИЧЕСКИЕ ОСНОВЫ ГОМОГЕННОГО ЗАРОДЫШЕОБРАЗОВАНИЯ (ПО ГИББСУ — ФОЛЬМЕРУ)
Рассмотрим образование в объеме старой (исходной) фазы, находящейся в метастабильном состоянии, зародыша новой более стабильной фазы; для простоты будем считать, что зародыш имеет сферическую форму и состоит из одного компонента, молярный объем которого равен Vm.
При образовании частицы (зародыша) радиусом г возникает поверхность раздела старой и новой фаз, равная 4nf, с которой связана поверхностная энергия 4пР' а. Вместе с тем, образование частицы связано с переходом вещества в более стабильное состояние, что сопровождается снижением его химического потенциала от значения per в старой фазе до более низкого значения рк в новой фазе. Разность Ист — Вн характеризует степень отклонения исходной маточной фазы от стабильного состояния; применительно к конкретным системам она может быть выражена через соответствующие термодинамические параметры (например, давление, температуру). Поскольку частица содержит 4п^/3 Ут молей вещества новой фазы, общее уменьшение свободной энергии системы при переходе в более стабильное состояние равно W (Pcr-P")/3K".
Таким образом, работа образования зародыша новой фазы Поможет быть записана в виде:
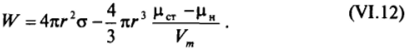
В выражении (VI. 12) первое слагаемое положительно и растет при увеличении г как г2, второе слагаемое при рст — цн > О отрицательно и по абсолютной величине растет как ?. Поэтому при наличии пересыщения на кривой зависимости Щг) должен существовать максимум.
Размер частицы гс, отвечающий максимуму на кривой fV®f можно найти из условия равенства нулю производной по радиусу d V®/dr = О (при этом вторая производная меньше нуля 62Щг)/дг < 0). Отсюда гс равно:

Частица радиусом гс, соответствующем максимуму кривой Щг)у называется критическим зародышем новой фазы; она находится в неустойчивом равновесии со старой фазой. Неустойчивый характер равновесия со средой критического зародыша виден из рис. VI-19. Напомним (см. 1.5.2), что химический потенциал р (г) зародыша радиусом г повышен по сравнению со значением для макроскопической новой фазы р" на величину 2а VJr вследствие действия капиллярного давления. Точке пересечения кривой р (г) (рис. VI-19) со значением химического потенциала старой фазы рст, т. е. равновесию зародыша со старой фазой, отвечает условие.
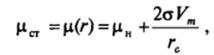
что совпадает с выражением (VI. 13).

Рис. VI-19. Условия равновесия критического зародыша и старой фазы.
Неустойчивый (лабильный) характер равновесия зародыша со средой связан с тем, что при размерах зародыша меньших критического химический потенциал вещества в нем выше химического потенциала вещества в старой фазе и зародышу термодинамически выгодно раствориться; наоборот, если г > гс, термодинамически выгоден рост зародыша за счет перехода в него вещества старой фазы. Вопрос о возможности в этих условиях возникновения критического зародыша будет рассмотрен ниже при анализе кинетики зародышеобразования.
Высота максимума на кривой Щг) — работа образования критического зародыша Wc — может быть получена подстановкой выражения для гс в (VI. 12). Это дает:

Выражение для Щ может быть также представлено еще в двух формах. Если исключить величину ЦсТ — цн, используя соотношение (VI.13), имеем:

где Sc — поверхность критического зародыша. Таким образом, работа образования критического зародыша равна одной трети от его поверхностной энергии; остальные две трети компенсируются работой перехода вещества дисперсной фазы в более стабильное состояние. Русановым было показано, что полученное Гиббсом выражение (VI. 15) для работы образования критического зародыша может быть положено в основу наиболее строгой формулировки термодинамики дисперсных систем, в частности учитывающей зависимость поверхностного натяжения от радиуса частицы.
Аналогично при исключении о из (VI. 14) получаем:

где Уе — объем критического зародыша. Выражение (VI. 16) будет использовано ниже при рассмотрении гетерогенного образования зародышей.
На рис. VI-20 изображена форма энергетического барьера при разных пересыщениях (pej — ц"). В отсутствие пересыщения (ц^- - ц" = 0) зависимость Щг) имеет вид параболы Щг) = 4яЛт (рис. VI-20), при этом г,-«» и Щ -> оо. При внедрении в метастабильную область (цст — цн > 0) на кривой Щг) появляется максимуму, е. Щ и имеют конечные значения, которые уменьшаются по мере роста пересыщения (Цст — ц"). Таким образом, работа образования критического зародыша Wc может рассматриваться как высота энергетического барьера, который необходимо преодолеть для дальнейшего самопроизвольного роста зародышей новой фазы.
В соответствии с уравнением (VI. 14) работа образования критического зародыша обратно пропорциональна квадрату пересыщения (цст — Цн)2— Поэтому для самопроизвольного возникновения новой фазы в гомогенной системе необходимо заметное внедрение в метастабильную область. Наблюдающееся часто образование новой фазы при весьма малом пересыщении и даже в его отсутствие связано с наличием посторонних включений, определяющих протекание процесса по гетерогенному механизму (см. ниже).

Рис. VI-20. Влияние степени метастабильности — ц. на форму энергетического барьера, радиус г, и работу IV образования критического зародыша.
Чтобы получить связь работы образования критических зародышей с непосредственно задаваемыми или измеряемыми макроскопическими параметрами, надо выразить через них величину Цст — рн, привлекая различные уравнения состояния в зависимости от фазового состояния старой и новой фаз. Рассмотрим такой переход для основных случаев образования новой фазы внутри исходной метастабильной.
Конденсация пересыщенного пара. В качестве параметра, характеризующего состояние исходной метастабильной фазы, целесообразно использовать давление р. Соответственно степень внедрения в метастабильную область Цст — Цн следует выразить через отклонение давления исходного пересыщенного пара р" от равновесного давления насыщенного параро (над плоской поверхностью). Используя соотношение (1.23), можно написать.

Тогда для работы образования критического зародыша получаем.
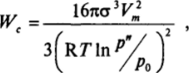
где отношение р?'/р0 = а есть пересыщение пара.
Кристаллизация (конденсация) из раствора. Аналогично может быть рассмотрен и процесс выделения твердой или жидкой фазы (с молярным объемом Vm) из раствора с пересыщением, а = с/со, где с и со — концентрация пересыщенного и насыщенного растворов. Если раствор близок к идеальному, то выражение для работы образования критического зародыша принимает вид:
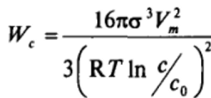
Для неидеального раствора в это выражение войдут коэффициенты активности.
Киление и кавитация. В процессах кипения и кавитации зародыши новой газообразной фазы (пузырьков пара) возникают внутри мстастабильной жидкой фазы. При кипении жидкости в открытом (незамкнутом) сосуде жидкость испаряется в неограниченный объем (атмосферу), и давление пара над плоской поверхностью жидкости не повышается, так что процесс кипения происходит при атмосферном давлении. (В замкнутом же сосуде, где значительная часть его объема занята жидкостью, кипение практически невозможно, так как система придет к равновесию раньше, чем будет достигнуто необходимое пересыщение.) Соответственно, при кипении давление p^(rt) в критическом зародыше радиусом г( превышает атмосферное на величину 2o/rt. При кавитации образование так называемых кавитационных пузырьков происходит в условиях растяжения жидкости, когда давление в ней отрицательно: jf < 0. Возникновение и последующее захлопывание кавитационных пузырьков может иметь место, например, при работе гребных винтов и вызывают ускоренный износ их поверхности. Давление пара pf (rc) в кавитационном пузырьке с критическим размером гс оказывается лишь немного ниже давления р9 насыщенного пара, равновесного с плоской поверхностью, тогда как значение отрицательного давления в жидкости может быть очень велико: — & «рч (рис. VI-21). Как правило, кипение и кавитация связаны с процессом гетерогенного зародышеобразования; поэтому рассматриваемый случай гомогенного образования пузырьков пара внутри жидкой фазы относится к таким особым условиям, когда влияние стенок и инородных включений устранено.
Возникновение критического зародыша при вскипании растянутой жидкости отвечает условию равенства химических потенциалов в зародыше — паре — и в жидкости. С учетом соответствующих уравнений состояния жидкости и газа получаем.

Это отвечает (рис. VI-2I) равенству площадей вертикального прямоугольника / и горизонтальной фигуры 2.
По Гиббсу изменение энергии системы при возникновении частицы, находящейся в равновесии с исходной маточной фазой, обусловлено двумя причинами: во-первых, возникает поверхность раздела фаз со свободной энергией 4яЛт, и во-вторых, в области системы объемом давление оказывается повышенным до величины р" (г) по сравнению с давлением // в окружающей среде. Тогда общее изменение свободной энергии системы при образовании критического зародыша равно.
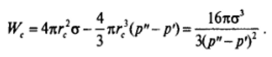
Зто выражение справедливо и для других рассмотренных ранее фазовых переходов.
Поскольку давление в зародыше р", как видно из рис. VI.21 не сильно отличается от давления насыщенного пара />", имеем
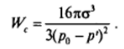
Кристаллизация из расплава. Так как в этом случае и возникающая (новая), и исходная (старая) фазы несжимаемы, умеренное увеличение давления не связано здесь с совершением заметной работы и не является эффективным способом внедрения в метастабильную область. Нужного эффекта можно достичь изменением температуры Т. Действительно, как следует из диаграммы равновесия (рис. VI-22), сравнительно небольшому изменению температуры расплава соответствует существенное изменение равновесного давления для твердой и жидкой фаз, а следовательно, и достижение высоких пересыщений (рст — рн), где рст относится к расплаву, ацн-к твердой фазе (рис. VI-23). Поэтому пересыщение в исходной фазе достигается, как правило, переохлаждением расплава. Применяя уравнение Гиббса — Гельмгольца к процессу затвердевания расплава, можно написать: 

Рис. VI-21. К анализу условий равновесия пузырька пара в жидкости
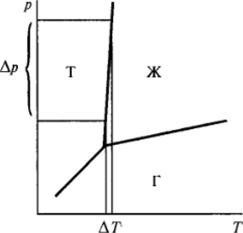
Рис. VI-22. Взаимосвязь изменений температуры Д7и давления Ар вдоль кривой равновесия при кристаллизации (плавлении).
или.

Рис. VI-23. Зависимость химического потенциала твердой и жидкой фаз от температуры Т
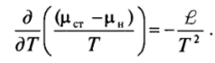
Предполагая, что теплота плавления ?
(на моль вещества) не зависит от температуры, после интегрирования оттемпературы плавления Га1, при которой (цст — - рн) = 0, до температуры Гполучаем.
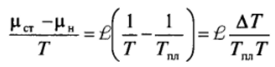
или.

где АТ= Тт — Г>0.
Подставляя последнее выражение в (VI-14), получаем для работы образования критического зародыша в расплаве:
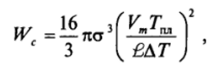
где Vm — молярный объем твердой фазы.