Общая характеристика серы

Сера как простое вещество образует несколько разновидностей. Обычная сера — желтое кристаллическое хрупкое вещество, называемое ромбической серой. Встречаются красивые кристаллы природной серы в местах выхода вулканических газов (Камчатка, Курильские острова). Ромбическая сера, устойчивая при обычных условиях, плавится при 112,8°С. Но жидкая сера при 119 °C начинает кристаллизоваться в виде… Читать ещё >
Общая характеристика серы (реферат, курсовая, диплом, контрольная)
В группе VIA к широко известным и распространенным в природе химическим элементам относится также сера. В земной коре сера находится в виде целого ряда минералов, образующих богатые залежи. Нередко встречается самородная сера, т.с. простое вещество S (S8). Очень распространены соединения серы с металлами. Многие из них наиболее ценны как руды для получения металлов: свинцовый блеск PbS, цинковая обманка ZnS, медный блеск CuS и др. Минерал пирит FeS2 (железный колчедан), образующий кубические кристаллы цвета латуни, служит главным образом как сырье для получения серной кислоты.
Большое распространение имеют также некоторые сульфаты. Минералы гипс и ангидрит (кристаллогидрат CaS04 • 2Н20 и безводный сульфат кальция) образуют местами целые горы. Сульфаты магния и натрия содержатся в морской воде. Прозрачные кристаллы образует сульфат стронция SrS04 — целестин. Барит, или тяжелый шпат BaS04, широко применяется для производства белил и как наполнитель в бумажной и резиновой промышленности. Например, слой барита наносится на фотобумагу. В значительном количестве сера содержится в каменном угле и при его сжигании попадает в атмосферу. В воздухе постоянно присутствует оксид cepbi (IV) S02. Если бы эта сера извлекалась из продуктов сжигания угля, то появилась бы возможность резко сократить добычу традиционных серных руд. Одновременно уменьшилось бы вредное воздействие S02 на растительность и пресные водоемы. Сера всегда имеется в белках, так как аминокислоты цистеин и метионин содержат серу. Общая масса серы в организме человека -120 г.
Мировая добыча серы превышает 60 млн т. Более половины этого количества идет на производство серной кислоты, а остальное — на производство сульфитов, резины, средств борьбы с вредителями в сельском хозяйстве.
Природная сера состоит из четырех устойчивых изотопов, причем 95% в этой смеси приходится на изотоп По химическим свойствам сера не проявляет значительного сходства с кислородом. Главное, что сближает эти два элемента — это двухвалентное состояние в соединениях с большинством химических элементов. При этом следует отметить, что в соединениях между кислородом и серой кислород остается двухвалентным, а сера может быть четырехи шести валентной. Высшие валентные состояния серы возможны благодаря наличию свободного 3</-подуровня, на орбитали которого переходят один или два электрона атома серы с 35- и Зр-подуровней:
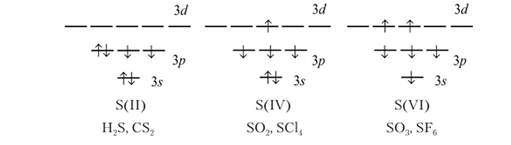
Одним из важных и характерных свойств атомов серы является способность образовывать цепочки:
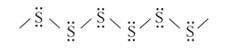
Если атомы кислорода соединяются в цепочки нс более чем из трех атомов (в молекуле озона), то сера при определенных условиях дает цепочки из сотен тысяч атомов. Два связанных между собой атома серы -8−8- часто служат перемычкой внутри белковой молекулы.
Сера. Простые вещества
Сера как простое вещество образует несколько разновидностей. Обычная сера — желтое кристаллическое хрупкое вещество, называемое ромбической серой. Встречаются красивые кристаллы природной серы в местах выхода вулканических газов (Камчатка, Курильские острова). Ромбическая сера, устойчивая при обычных условиях, плавится при 112,8°С. Но жидкая сера при 119 °C начинает кристаллизоваться в виде темпо-желтых игольчатых кристаллов моноклинной системы. Таким образом, сера образует две разные твердые фазы, но ниже 112,8°С устойчива ромбическая сера. Температура кипения серы — 444,6°С. Сера не растворяется в воде, но растворяется в сероуглероде и бензоле.
Твердая сера и ее растворы состоят из молекул 88. Это кольцевые молекулы, по форме напоминающие корону (рис. 19.3).
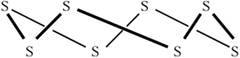
Рис. 19.3. Строение молекулы серы.
При написании химических реакций молекулярное строение серы обычно не учитывают и записывают ее в виде атомов. Выше температуры плавления сера постепенно темнеет и при ~250°С превращается в вязкую массу красно-бурого цвета, состоящую из очень длинных цепочек 8Я.
Выше 300 °C сера снова становится подвижной жидкостью. Кипящая сера образует оранжево-желтые пары. В парах серы содержатся молекулы Б8, 5б, 84 и $2. Молекулы 52 по структуре близки к молекулам кислорода 02.
Если расплавленную серу, нагретую до кипения, вылить в холодную воду (рис. 19.4), то она превращается в коричневую мягкую резиноподобную массу, растягивающуюся в нити. Эта разновидность серы называется пластической серой. Она состоит из зигзагообразных очень длинных молекул Б, где п достигает 100 000 и более. Через непродолжительное время пластическая сера становится хрупкой, приобретает желтый цвет и постепенно превращается в ромбическую серу 58.
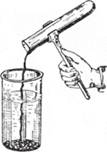
Рис. 19.4. Получение пластической серы.
Серу добывают непосредственно из природных месторождений. Добытую серу для очистки перегоняют в специальных рафинировочных печах. Сначала пары серы поступают в большую кирпичную камеру. На холодных стенках сера осаждается в виде светло-желтого порошка, известного под названием серного цвета. На горячих стенках при температуре около 120 °C сера превращается в жидкость, которую выпускают в деревянные формы, где она застывает в виде палочек. Полученная таким путем сера называется черенковой.
Известно также много реакций, при которых сера выделяется из сложных веществ. Сера образуется при смешивании газообразных сероводорода и сеонистого газа:

Сгорание сероводорода в условиях недостатка кислорода также ведет к образованию серы (см. ниже).
Оксиды серы (1У) и углерода (Н) реагируют с выделением серы в присутствии катализатора:
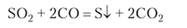
Эту реакцию применяют для очистки продуктов сгорания топлива от примеси серы.
Серу можно получить по реакции в водном растворе. При добавлении соляной кислоты к раствору тиосульфата натрия Ыа25203 жидкость мутнеет, и в осадок постепенно выпадает светло-желтая мелкодисперсная сера:
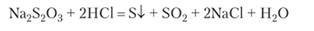
Химические превращения серы происходят главным образом при нагревании. Без участия других реагентов сера образует целый ряд разных молекул:
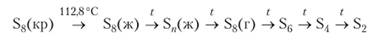
Сера соединяется почти со всеми неметаллами и металлами. Реакция; водородом обратима:
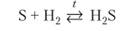
Сера реагирует с галогенами, образуя соединения в двухи четырехвалентном состоянии. Только с фтором при его избытке образуется газообразное устойчивое соединение БР6.
На воздухе и в кислороде сера горит голубым пламенем:
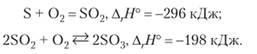
При горении серы температура превышает 800 °C, вследствие чего равновесие второй реакции сильно смещается влево и лишь ~5% серы превращается в $ 03.
С металлами сера реагирует с большим выделением теплоты. При поджигании смеси порошков серы и цинка происходит яркая вспышка. Образуется сульфид цинка белого цвета:
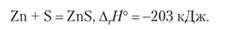
С некоторыми-элементами 5-го и 6-го периодов сера реагирует легче, чем кислород. Серебро устойчиво к действию кислорода, но в смеси с серой без нагревания образует бурый сульфид:
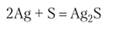
Сера реагирует с оксидами, кислотами и солями, проявляющими сильные окислительные свойства:
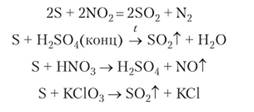
При нагревании с раствором щелочи сера реагирует по такому же типу, как галогены, т. е. дисиропорционирует:

Атомы серы из простого вещества могут присоединяться к сере в некоторых сложных веществах:
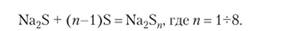
В образовавшемся полисульфиде натрия имеются цепочки из атомов серы с отрицательными зарядами на концах:
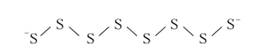
Раствор сульфита натрия реагирует с серой при кипячении:

В образующемся бесцветном растворе находится соль тиосерной кислоты — тиосульфат натрия.