Влияние нанопорошков оксидов металлов на успех прохождения личиночных стадий развития озерной лягушкой (Rana Ridibunda Pall)

В обеих концентрациях сточных вод наибольшим протекторным действием обладает оксид кобальта, снижающий смертность до 25%. По нашему мнению это объясняется наибольшей удельной поверхностью наночастиц кобальта из всех изученных оксидов металлов. При добавлении оксидов железа и никеля в 10%-ные сточные воды, а также оксида железа в 25%-ные сточные воды не отмечена среднелетальная концентрация, хотя… Читать ещё >
Влияние нанопорошков оксидов металлов на успех прохождения личиночных стадий развития озерной лягушкой (Rana Ridibunda Pall) (реферат, курсовая, диплом, контрольная)
ВЛИЯНИЕ НАНОПОРОШКОВ ОКСИДОВ МЕТАЛЛОВ НА УСПЕХ ПРОХОЖДЕНИЯ ЛИЧИНОЧНЫХ СТАДИЙ РАЗВИТИЯ ОЗЕРНОЙ ЛЯГУШКОЙ (RANA RIDIBUNDA PALL.)
Активное развитие исследований в области нанообъектов и наноструктур поставило ряд вопросов об их безопасности. Оценка безопасности наноструктур для объектов окружающей среды и здоровья человека становится первостепенной задачей токсикологии. Наноструктуры, как правило, легче вступают в химические превращения, нежели более крупные объекты того же состава, и поэтому способны образовывать комплексные соединения с ранее неизвестными свойствами. Это обстоятельство увеличивает технологическую перспективность нанообъектов и в то же время заставляет с особым вниманием относиться к связанным с ними экологическим рискам [1].
К наноматериалам относят частицы с размером не более 100нм. Они отличаются от молекул и ионов того же состава не только размерами, но и большей удельной поверхностью, высокой адсорбционной и кумулятивной способностями. У них увеличивается химический потенциал на межфазной границе, в результате чего изменяется растворимость, реакционная и каталитическая способности [1,2]. Ряд авторов указывают на опасность канцерогенного эффекта наночастиц; отмечают способность генерировать активные формы кислорода (последнее обусловлено наличием реакционных центров). Наночастицы стабильны, не подвергаются биотрансформациям и не выводятся из клетки, что вызывает в клетках стресс и их разрушение [2]. Также в литературе имеются сведения о том, что наночастицы могут оказывать протективное воздействие на живые организмы, увеличивая резистентность организма к различным токсикантам [3].
Один из первостепенных вопросов, на который необходимо получить ответ, касается эффектов наночастиц в отношении различных живых организмов, являющихся представителями различных трофических уровней. В этом плане весьма актуально изучение влияния наночастиц металлов на земноводных, в частности, на их растительноядные личиночные стадии консументов первого порядка. Сказанным объясняется выбор объекта данного исследования головастики озерной лягушки Rana ridibunda Pall.
Цель данного исследования изучение выживаемости головастиков, темпа роста и темпа развития при экспозиции в присутствии наночастиц кобальта, никеля, меди и железа, а также при добавлении указанных наночастицы в растворы сточной воды сахарного завода низких концентраций (10 и 25%).
В Краснодарском крае в настоящее время действует 16 сахарных заводов, очистка производственных сточных вод на них осуществляется на полях фильтрации и в земляных отстойниках. На ряде заводов края, поля фильтрации которых размещены на тяжелых суглинистых и глинистых грунтах, очистка происходит путем отстаивания и осветления. Со сточными водами заводов в пруды-отстойники попадают, кроме органического осадка такие вещества, как хлориды, сульфаты, фосфаты, нитриты, нитраты, соединения кальция, магния, ПАВы и нефтепродукты [4,5]. Попадание сточных вод сахарных заводов в русла рек является причиной заморных явлений рыб и нарушения экологического состояния водной среды (газового режима и содержания органических веществ и механических примесей) [6].
В прудах-отстойниках сахарного завода обитают взрослые озерные лягушки (Rana ridibunda). В ранее проведенных нами исследованиях было показано, что сравнительно невысокие концентрации стоков (10−25%) не оказывают на них отрицательного влияния. В связи с этим мы решили выяснить, какое влияние оказывают данные концентрации на ранние стадии онтогенеза озерной лягушки.
Эксперимент проходил с 25 апреля до 10 августа 2009 г.
Икра озерной лягушки была взята из условно чистого водоема, находящегося на территории Ботанического сада Кубанского государственного университета. Из икры в чистой воде были получены головастики. Плотность посадки головастиков в каждый вариант опыта составляла 10 особей на 1л воды или раствора. Животных содержали в 3-литровых емкостях: контрольных в отстоянной водопроводной воде, а опытных в двух концентрациях сточных вод сахарных заводов — 10%-ной и 25%-ной. Растворы разбавляли отстоянной водопроводной водой.
К каждому из 3 исследуемых вариантов (контроль и 2 концентрации сточных вод) были добавлены нанопорошки оксидов железа, меди, никеля и кобальта. Размеры наночастиц металлов: оксид кобальта и оксид никеля 11 нм, оксид меди 14 нм, оксид железа II 22,8 нм. Удельная поверхность соответственно 100, 79, 70 и 50 м2/г соответственно. Для всех оксидов металлов была использована одинаковая концентрация 20 мг суспензии на 1 л раствора.
Эксперимент проводили в лабораторных условиях по стандартной методике [7], до завершения метаморфоза в контроле. Фиксировали сроки наступления основных стадий развития и метаморфоза [8]. Весь полученный материал обработан соответствующими статистическими методами [9].
Мы полагаем, что поступление наночастиц происходило через кожу, кроме того, на более поздних стадиях развития было возможным пероральное поступление с кормом (вареные листья одуванчика).
Всего в контроле и опыте было использовано 360 головастиков озерной лягушки. Всех завершивших метаморфоз животных мы выпустили на территории Ботанического сада КубГУ.
Полученные нами данные свидетельствуют о неоднозначном влиянии наночастиц оксидов меди, никеля, железа и кобальта на смертность головастиков озерной лягушки.
Добавление оксидов железа, кобальта и никеля в отстоянную водопроводную воду в среднем увеличило скорость гибели головастиков по сравнению с контролем в 2 раза. Ни в одном из вариантов опыта не была достигнута 100%-ная смертность, хотя 50%-ная была отмечена под действием всех трех оксидов (рис.1). Исключение составил оксид меди: его добавление вызывало очень быстро наступавшую (в течение 15 дней) 100%-ную гибель головастиков.
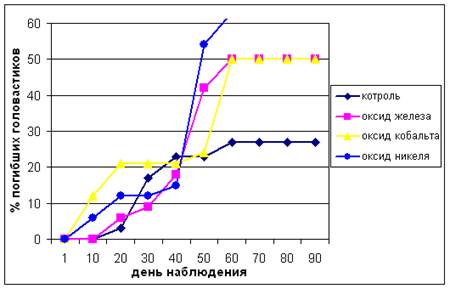
Рисунок 1 Смертность головастиков озерной лягушки в контроле и при действии наночастиц оксидов металлов.
В одной из работ [10] приводятся данные о смертности головастиков озерной лягушки в растворах сульфата железа, которая находилась в пределах 3437%. Сравнение этих данных с величиной смертности при экспозиции в присутствии нанопорошка оксида железа показывают, что биоактивность наножелеза существенно увеличена по сравнению с его ионной формой.
Иная картина наблюдалась при добавлении наночастиц оксидов металлов к сточным водам различных концентраций (рис. 2, 3).
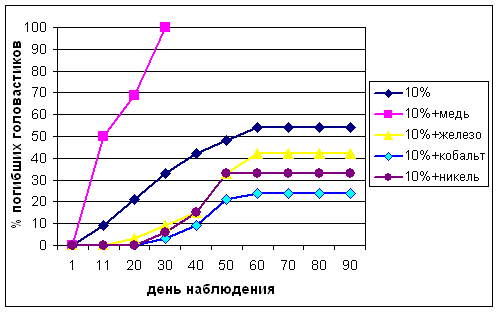
Рисунок 2 Смертность головастиков озерной лягушки в сточной воде сахарного завода 10%-ной концентрации и при добавлении наночастиц оксидов металлов.
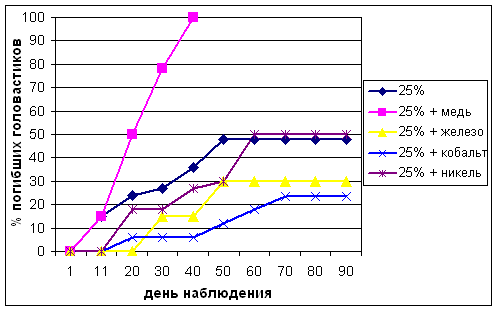
Рисунок 3 Смертность головастиков озерной лягушки в сточной воде сахарного завода 25%-ной концентрации и при добавлении наночастиц оксидов металлов.
В обеих концентрациях сточных вод наибольшим протекторным действием обладает оксид кобальта, снижающий смертность до 25%. По нашему мнению это объясняется наибольшей удельной поверхностью наночастиц кобальта из всех изученных оксидов металлов. При добавлении оксидов железа и никеля в 10%-ные сточные воды, а также оксида железа в 25%-ные сточные воды не отмечена среднелетальная концентрация, хотя без их добавления в сточных водах соответствующих разведений этот показатель достигнут. Добавление наночастиц оксида меди и в этих обоих случаях вызывают 100%-ную гибель головастиков, хотя она и наступает позже по сравнению с действием оксида меди в чистой воде на 15−25 дней.
Данные по среднесуточному приросту длины тела головастиков в течение 60 дней эксперимента приведены в таблице.
У контрольных головастиков (в чистой воде) темп прироста возрастал в интервале между 30 и 40 днями, а затем несколько снижался. При добавлении всех исследованных нанопорошков оксидов металлов (за исключением меди, при добавлении которой все головастики очень быстро погибли, как мы отмечали ранее) прирост тела в среднем за 60 дней оставался на уровне контрольных значений, хотя динамика этого показателя по декадам была довольно разнообразной.
Таблица 1 Суточный прирост длины тела (мм) головастиков озерной лягушки
Вариант. | 10 дней. | 20 дней. | 10 дней. | 20 дней. | В среднем за 60 дней. | |
контроль. | 0,25. | 0,33. | 0,45. | 0,34. | 0,34. | |
кобальт. | 0,39. | 0,19. | 0,28. | 0,49. | 0,34. | |
железо. | 0,44. | 0,16. | 0,69. | 0,44. | 0,37. | |
никель. | 0,23. | 0,36. | 0,11. | 0,65. | 0,39. | |
10% стоки. | 0,52. | 0,09. | 0,05. | 0,50. | 0,29. | |
10%стоки+кобальт. | 0,33. | 0,16. | 0,34. | 1,19. | 0,42. | |
10%стоки+железо. | 0,56. | 0, 36. | 0,19. | 0,83. | 0,48. | |
10%стоки+никель. | 0,26. | 0,30. | 0,35. | 0,70. | 0,43. | |
25% стоки. | 0,39. | 0,31. | 0,11. | 0,44. | 0,29. | |
25%стоки+кобальт. | 0,32. | 0,30. | 0,26. | 0,77. | 0,41. | |
25%стоки+железо. | 0,52. | 0,40. | 0,28. | 0,64. | 0,46. | |
25%стоки+никель. | 0,18. | 0,32. | 0,37. | 0,60. | 0,40. | |
Так, в оксидах кобальта и железа наблюдали два пика прироста длины в начале и в конце наблюдения, а в оксиде никеля один (весьма значительный), только в конце наблюдения, между 40 и 60 днями.
Минимальный (и при этом одинаковый) дневной прирост общей длины тела головастиков отмечен в растворах сточной воды концентрации 10% и 25% в среднем 0,29мм/сутки. Этот средний показатель достигнут головастиками в растворе сточной воды более низкой концентрации в основном в первой, а также в пятой и шестой декадах жизни; а в растворе сточных вод концентрации 25% темп прироста длины тела был довольно равномерным.
При добавлении нанопорошка оксида кобальта к растворам сточных вод обеих концентраций мы отмечаем одинаковое увеличение прироста тела в среднем за весь период до 0,410,42 мм/сутки (на 4145% выше, чем в растворе сточных вод без добавления нанопорошка), причем наиболее интенсивный рост головастиков наблюдался в интервале между 40 и 60 днями.
При добавлении нанопорошка оксида никеля к растворам сточных вод мы также отмечали ускорение темпов роста головастиков, динамика этого процесса похожа на ту, что была отмечена ранее при добавлении оксида кобальта, постепенное увеличение прироста на протяжении 40 дней, а затем, в конце наблюдения заметный подъем. В среднем за весь период темп прироста составляет 0,400,43 мм/сутки (на 3848% выше, чем в растворе сточных вод без добавления нанопорошка).
При добавлении нанопорошка оксида железа к растворам сточных вод отмечено максимальное увеличение прироста тела головастиков в среднем за весь период до 0,460,48 мм/сутки (на 5966% выше, чем в растворе сточных вод без добавления нанопорошка); однако динамика прироста несколько отличается от описанной для оксидов кобальта и никеля, а именно: отмечены два пика ускорения роста животных в начале и конце наблюдения.
При добавлении нанопорошков всех исследованных оксидов металлов (за исключением оксида меди) в 10%-ных растворах сточных вод сахарного завода общий прирост длины тела за 60 дней наблюдения увеличивался в большей степени на 4566%, а в 25%-ных растворах сточных вод на 3859%. Самый высокий прирост длины тела обнаружен при добавлении к растворам сточной воды нанопорошка оксида железа (0,460,48 мм/сутки).
Отмеченное ускорение роста длины тела головастиков, на наш взгляд, можно объяснить тем, что наночастицы имеют большую удельную площадь поверхности и лучше адсорбируют вредные вещества [2]. В результате в растворе сточных вод уменьшается количество загрязнителей.
Таким образом, обнаружено, что под действием нанопорошков оксидов тяжелых металлов на темпы роста головастиков озерной лягушки: при добавлении их к чистой воде и растворам сточных вод сахарного завода (10 и 25% концентрации), как правило, ускоряется темп роста земноводных. Ранее [10] было установлено, что при содержании головастиков в растворах сульфата железа (концентрации 0,510,0 мг/л) размеры озерных лягушек при метаморфозе достоверно превосходят контрольных особей, т. е. соединения железа как в ионной, так и в наноформе, ускоряют темпы роста головастиков озерной лягушки.
До 46 стадии развития головастиков озерной лягушки включительно развитие земноводных во всех вариантах нашего эксперимента происходило синхронно. 4749 стадии (хорошо развитые задние конечности) головастики достигали на 8090 дни наблюдения в большинстве вариантов опыта. Исключение составляли варианты опыта с добавлением нанопорошков оксидов железа и кобальта как к чистой воде, так и к растворам сточных вод сахарного завода обеих концентраций, где головастики этих стадий достигали на 7090 дни (то есть появлялись первые особи с развитыми задними конечностями раньше, а весь период затягивался). 5051 стадии (хорошо развитые передние конечности) и 5253 стадии (редукция хвоста) наступали на 10 дней позднее у амфибий практически во всех вариантах опыта по сравнению с контролем (чистая вода).
В лабораторном эксперименте с головастиками озерной лягушки было установлено, что в растворах сульфата железа (0,510,0 мг/л) развитие происходит практически синхронно с контролем, то есть соли железа исследованных концентраций не оказывают существенного влияния на процесс развития головастиков озерной лягушки [10].
Следовательно, в целом можно говорить о некотором удлинении сроков личиночного развития озерной лягушки, отмеченного в нашем эксперименте.
Таким образом, оксиды нанометаллов оказывают неоднозначное действие на показатели раннего онтогенеза озерной лягушки. Так 3 из 4 изученных оксидов нанометаллов (кобальт, железо, никель) снижают смертность головастиков при их помещении в растворы сточных вод сахарных заводов, особенно это действие проявляется при добавлении оксида кобальта. Эти же оксиды ускоряют темпы роста головастиков в растворах сточных вод, при этом наибольший средний прирост отмечен у головастиков в растворах оксида железа. Однако добавление оксидов железа, кобальта и никеля к чистой воде существенно не меняет биологические показатели головастиков озерной лягушки. Только оксид меди оказывает противоположное воздействие, он вызывает в каждом из исследованных вариантов опыта ускоренную (и 100%-ную) гибель головастиков озерной лягушки.
- 1. Глушкова А. В., Радилов А. С., Рембовский В. Р. Нанотехнологии и нанотоксикология — взгляд на проблему // «Методологические проблемы изучения и оценки биои нанотехнологий (нановолны, частицы, структуры, процессы, биообъекты) в экологии человека и гигиене окружающей среды». Материалы пленума Научного совета по экологии человека и гигиене окружающей среды РАМН и Минздравсоцразвития Российской Федерации / Под ред. акад. РАМН Ю. А. Рахманина. М, 2007.
- 2. Жолдакова З. И., Синицына О. О., Некоторые сходства и различия в токсических свойствах наночастиц и других химических веществ // «Методологические проблемы изучения и оценки биои нанотехнологий (нановолны, частицы, структуры, процессы, биообъекты) в экологии человека и гигиене окружающей среды». Материалы пленума Научного совета по экологии человека и гигиене окружающей среды РАМН и Минздравсоцразвития Российской Федерации / Под ред. акад. РАМН Ю. А. Рахманина. М, 2007. С. 52−57
- 3. Коваленко Л. В., Фолманис Г. Э. Биологические активные нанопорошки железа. М: Наука, 2006
- 4. Методические указания по обоснованию нормативов предельно-допустимого сброса сточных вод и загрязняющих веществ на поля фильтрации сахарных заводов и размера платы за негативное воздействие на окружающую среду Краснодар, 2006. 35 с.
- 5. Водное хозяйство сахарных заводов / Под ред. Спивчака В. В. Курск: ГНУ РНИИСП Россельхозакадемии, 2005 г. 167с.
- 6. Гриб И. В., Гончаренко Д. И., Войтышина Д. И. Сапонин как фактор массовой гибели рыб в реках Украины // Гидробиологический журнал. 2006. Т. 42, № 4 С. 65−76
- 7. Пястолова О. А. Личинки Зерноводных и их лабораторное содержание // Руководство по изучению земноводных и пресмыкающихся. Киев, 1989. С. 134−135
- 8. Дабагян Н. В., Слепцова Л. А., Травяная лягушка Rana temporaria L.// Объекты биологии развития. М., 1975. С. 442−462
- 9. Лакин Г. Ф. Биометрия — М.: Изд-во Высшая школа, 1990 г. 352с.
- 10. Пескова Т. Ю. Действие смесей тяжелых металлов на головастиков бесхвостых земноводных // Известия Самарского научного центра РАН. Актуальные проблемы экологии. Т.1. Самара, 2003. С. 157 164.