Изучение механизмов активации васкулярного эндотелия у больных псориазом и артериальной гипертензией

Ведущим звеном патогенеза псориаза является миграция активированных Т-лимфоцитов в кожу после их взаимодействия с антигенпрезентирующими (дендритными) клетками эпидермиса в регионарных лимфоузлах. В области псориатических высыпаний обнаруживают значительное количество дендритных клеток. В инфильтрате псориатической бляшки присутствуют Т-хелперы первого типа, продуцирующие такие провоспалительные… Читать ещё >
Изучение механизмов активации васкулярного эндотелия у больных псориазом и артериальной гипертензией (реферат, курсовая, диплом, контрольная)
Аннотации
С целью исследования особенностей экспрессии васкулоэндотелиального фактора роста у пациентов, страдающих одновременно псориазом и артериальной гипертензией, у 102 больных методом непрямого твёрдофазного иммуноферментного анализа изучен уровень VEGF-A в сыворотке крови. Установлено, что в группе больных псориазом и артериальной гипертензией, которая во всех группах представлена гипертонической болезнью II стадии, уровень сигнального белка васкулогенеза VEGF-A был максимальным и составлял 694,44 (567,36−829,87) пг/мл, что на 48,27% (p<0,01) статистически значимо выше, чем у лиц с псориазом, и более чем в 5 раз (p<0,01) превышал показатели группы больных только с ГБ. В то же время у больных псориазом без коморбидности уровень фактора роста эндотелия сосудов был выше в 3,5 раза (p<0,01) в сравнении с пациентами группы ГБ, у которых этот показатель не превышал 300 пг/мл. Это указывает на наибольшую активность ангиогенеза именно при сочетании у пациентов псориаза и ГБ. Полученные результаты свидетельствуют о наличии достоверной прямой взаимозависимости между показателями экспрессии VEGF-А и тяжестью клинического течения дерматоза у пациентов, страдающих одновременно псориазом и ГБ.
Ключевые слова: эндотелиальный сосудистый фактор роста, псориаз, гипертоническая болезнь.
Вивчення механізмів активації васкулярного ендотелію у хворих на псоріаз та артеріальну гіпертензію.
Г. І. Макуріна
З метою дослідження особливостей експресії васкулоендотеліального фактора росту в пацієнтів, які страждають одночасно на псоріаз та артеріальну гіпертензію, у 102 хворих методом непрямого твердофазного імуноферментного аналізу вивчили рівень VEGF-A в сироватці крові. Встановили, що у групі хворих на псоріаз та артеріальну гіпертензію, що в усіх групах представлена гіпертонічною хворобою ІІ стадії, рівень сигнального білка васкулогенезу VEGF-A був максимальний — 694,44 (567,36−829,87) пг/мл, що на 48,27% (p<0,01) статистично значуще вище, ніж в осіб із псоріазом, і більше ніж у п’ять разів (p<0,01) перевищував показники групи хворих тільки на ГБ. Водночас у хворих на псоріаз без коморбідності рівень фактора росту ендотелію судин був вищим у 3,5 раза (p<0,01) при зіставленні з пацієнтами групи ГБ, у яких цей показник не перевищував 300 пг/мл. Це вказує на найбільшу активність ангіогенезу саме при поєднанні в пацієнтів псоріазу та ГБ. Результати свідчать про наявність вірогідної прямої взаємозалежності між показниками експресії VEGF-А та тяжкістю клінічного перебігу дерматозу в пацієнтів, які страждають одночасно на псоріаз і ГБ.
Ключові слова: ендотеліальний судинний фактор росту, псоріаз, гіпертонічна хвороба.
Запорізький медичний журнал. — 2016. — № 1 (94). — С. 19−24
Vascular endothelium activation mechanisms study іn patients with psoriasis and essential hypertension
G.I. Makurina.
The aim. To study Vascular Endothelial Growth Factor-A expression in patients with both psoriasis and hypertension.
Methods and results. 102 patients were included. Vascular Endothelial Growth Factor-A level was detected with indirect ELISA method.
It was found that VEGF-A level was maximal in patients with psoriasis and hypertension stage II — 694.44 (567.36−829.87) pg/ml. That was statistically significantly higher (p<0,01) than in patients with psoriasis and more than 5 times (p<0,01) higher than VEGF-A levels patients with essential hypertension.
At the same time, vascular endothelial growth factor level in patients with psoriasis without essential hypertension was higher in 3.5 times (p<0,01) when compared with group of patients with essential hypertension, which did not exceed 300 pg/ml. This indicates it is most active angiogenesis in patients with a combination of psoriasis and essential hypertension.
Conclusion. The results indicated the direct relationship between the reliable indicators of VEGF-A expression and dermatosis clinical course severity in patients with both psoriasis and essential hypertension.
Key words: Vascular Endothelial Growth Factor-A, Psoriasis, Essential Hypertension.
Zaporozhye medical journal 2016; № 1 (94): 19−24.
Введение
Псориаз (ПС) — одно из наиболее часто встречающихся, тяжёлых и упорно протекающих заболеваний кожи. Заболеваемость данным дерматозом в мире составляет около 3%, причём ежегодно в Украине регистрируется 0,75% новых случаев псориаза. В последнее время отмечается рост количества тяжёлых инвалидизирующих форм заболевания, которые устойчивы к традиционной терапии. Исследования последних лет показали, что ПС является полигенным, иммунологически зависимым заболеванием, при котором нарушается эпидермальная пролиферация и дифференцировка кератиноцитов [1−3].
Ведущим звеном патогенеза псориаза является миграция активированных Т-лимфоцитов в кожу после их взаимодействия с антигенпрезентирующими (дендритными) клетками эпидермиса в регионарных лимфоузлах. В области псориатических высыпаний обнаруживают значительное количество дендритных клеток. В инфильтрате псориатической бляшки присутствуют Т-хелперы первого типа, продуцирующие такие провоспалительные цитокины, как интерлейкин-2, у-интерферон и фактор некроза опухоли а, которые вызывают клеточно-опосредованный иммунный ответ, и T-хелперы второго типа, продуцирующие провоспалительные цитокины — ИЛ-4, ИЛ-9, ИЛ-10, ИЛ-13, приводящие преимущественно к развитию гуморального иммунного ответа [4,5]. Инфильтрирующие кожу Т-лимфоциты, клетки моноцитарно-макрофагальной системы и кератиноциты активно вырабатывают провоспалительные цитокины, которые способствуют гиперпролиферации и нарушению дифференцировки кератиноцитов.
Кератиноциты поражённых участков кожи по принципу обратной связи вырабатывают цитокины, которые поддерживают активированное состояние Т-хелперов, образуя замкнутый круг [6,7].
В очагах поражения происходит гиперпролиферация кератиноцитов, а также нарушение их дифференцировки, которое гистологически проявляется резким межсосочковым акантозом с наличием тонких эпидермальных выростов, исчезновением зернистого слоя эпидермиса, паракератозом. Время транзита кератиноцитов из базального слоя эпидермиса к поверхности кожи значительно меньше, чем в норме. В роговой слой и паракератотические участки эпидермиса в прогрессирующей стадии мигрируют нейтрофилы, которые образуют микроабсцессы Мунро. Сосочковый слой дермы инфильтрируется лимфоцитами и гистиоцитами с примесью нейтрофилов. Капилляры терминальных аркад сосочкового слоя дермы расширяются, удлиняются, становятся фенестрированными [8−10].
Большинство исследователей считают, что при ПС происходит поражение не только кожи, но и системное повреждение различных органов и систем. В связи с этим и появился термин «псориатическая болезнь», которая характеризуется различной степенью вовлечённости в патологический процесс внутренних органов. Поражение сердечно-сосудистой системы при ПС возникает наиболее часто — до 40% случаев, причём формирование артериальной гипертензии (АГ) происходит в 30% случаев всей кардиальной патологии [11−12].
В патогенезе АГ ведущим звеном является ремоделирование сосудов как результат прогрессирования дисфункции эндотелиального слоя сосудов. Одним из основных биохимических маркеров дисфункции эндотелия является дефицит оксида азота — NO (либо недостаточная его продукция, либо его инактивация). При АГ к дефициту NO приводит образование избыточного количества свободных радикалов, деградация брадикинина, сниженная активность NO-синтазы. Окислительный стресс, дисфункция эндотелия и апоптоз могут сами по себе способствовать прогрессированию АГ, как взаимно дополняя друг друга, так и формируя «порочный круг». Если этот круг не прервать, то перечисленные состояния, развивающиеся в течение многих лет, могут привести к прогрессирующему повреждению органов-мишеней [13].
Начальным звеном патологической цепи при гипертонической болезни, формирующейся на фоне различных факторов риска, служит развитие первичного системного гуморального ответа («цитокиновый ответ»), а в последующем — эндотелиальной дисфункции (ЭД). Цитокины — низкомолекулярные белки и пептиды, которые могут продуцироваться самыми различными типами клеток: моноцитами, тканевыми макрофагами, лимфоцитами, клетками ретикулоэндотелиальной системы, эндотелием, полиморфно-ядерными лейкоцитами и главным образом нейтрофилами. Цитокины даже в малых концентрациях осуществляют гуморальную регуляцию межклеточных и межсистемных взаимодействий, определяют функциональную активность отдельных клеток, их способность к пролиферации и дифференцировке, выживаемость или программированную апоптотическую гибель [14].
ЭД обусловлена нарушениями клеточного энергетического метаболизма сосудов капиллярного уровня, что в первую очередь сопряжено с нарушением функций митохондрий. В генезе развития ЭД, так же как и в развитии ишемических и вторичных дегенеративных изменений в мозге, лежит формирование оксидативного стресса (ОС). В результате развития ЭД возникает дисбаланс между сосудорасширяющими, сосудосуживающими, антитромботическими факторами, а также между пролиферативными и провоспалительными факторами. ЭД тесно сопряжена с воспалением, а также дестабилизацией атеросклеротической бляшки. Одним из биологических маркеров ЭД служит фактор роста эндотелия сосудов (VEGF-А — Vascular Endothelial Growth Factor-A) [15]. Ингибирование или снижение активности VEGF-A индуцирует апоптоз эндотелиальных клеток. Фактор роста сосудистого эндотелия может продуцироваться различными типами клеток, в том числе и макрофагами, тромбоцитами, кератиноцитами, его активность не ограничивается только сосудистой системой, VEGF-A играет важную роль в нормальных физиологических функциях, таких как заживление раневой поверхности. Было доказано, что данный фактор имеет антиапоптотическое качество и способствует выживанию повреждённых и атипичных клеток организма, которые образуются при опухолях, воспалении. васкулоэндотелиальный псориаз дерматоз Важную роль играет VEGF-A и при заболеваниях сердечно-сосудистой системы, в частности при гипертонической болезни, ремоделируя сосудистую стенку [16]. Выявление данного маркера в сыворотке крови является наиболее ранним маркером развития ЭД при ещё не начавшемся активном внутрисосудистом воспалении. При ПС данный маркер в сыворотке крови также будет повышаться. Особый интерес в данном случае будут представлять пациенты с сочетанием ГБ и ПС, так как для каждой из этих патологий, согласно последним литературным данным, характерен рост сигнального белка васкулогенеза VEGF-A, и комбинация этих заболеваний может проявиться в усилении экспрессии сосудистого эндотелиального фактора роста, что очевидно сыграет немаловажную роль для ранней и более точной диагностики обострения данного коморбидного состояния и своевременного его лечения. Эти факты и обусловливают актуальность изучаемой темы.
Цель работы Оценить особенности экспрессии васкулоэндотелиального фактора роста у пациентов, страдающих псориазом в сочетании с ГБ, а также исследовать её взаимосвязь с клиническими проявлениями дерматоза и другими маркерами воспалительного процесса.
Материалы и методы исследования
Результаты настоящего исследования основаны на данных комплексного обследования и динамического наблюдения за 53 пациентами с ПС (27 из которых имели сопутствующую ГБ ІІ стадии) и 49 больными ГБ ІІ стадии без ПС.
Все больные были разделены на 3 группы: І - пациенты с ПС+ГБ — 27 человек, возраст колебался от 24 до 74 лет (16 мужчин и 11 женщин), длительность ПС и ГБ — 4,18±0,74 и 7,31±0,93 года соответственно; ІІ группа — пациенты с ПС — 26 человек, возраст — от 19 до 60 лет, 7 мужчин и 19 женщин, длительность ПС — 3,94±0,51 года; III группа — пациенты с ГБ — 49 человек, возраст — от 30 до 75 лет, 13 мужчин и 36 женщин, длительность — ГБ 7,96±1,04 года. Все пациенты.
11 и ІІІ групп имели II стадию ГБ с уровнем артериальной гипертензии I-II степени различного кардиоваскулярного риска, без адекватной систематической антигипертензивной терапии, у которых в результате комплексного клинико-анамнестического и инструментально-лабораторного обследования отсутствовали данные, свидетельствующие о вторичном характере гипертензии.
Группы больных были сопоставимы по основным клинико-демографическим данным. Все обследованные выразили письменное согласие на участие в проведении исследования.
В І и ІІ группах поражение кожи у 2/3 больных носило распространённый характер. У большинства больных І группы (73,1%) отмечались многократные рецидивы в течение года, в отличие от пациентов ІІ группы (25,9%). Анамнестически установлена отягощённая наследственность по псориазу у 6 пациентов ІІ группы и у 4 больных І группы. Зимний тип псориаза установлен у 11 больных (40,7%) І группы и у 12 (46,2%) ІІ группы, летний — у 2 (7,5%) и 2 (7,6%) соответственно, а недифференцированный — у 14 (51,8%) и 12 (46,2%).
Для оценки степени тяжести ПС использовался Psoriasis Area and Severity Index (индекс PASI), который является общепринятой системой оценивания тяжести дерматоза. Для оценки качества жизни пациентов определялся дерматологический индекс качества жизни путём заполнения анкеты-опросника The Dermatology Life Quality Index (DLQI). На основании осмотра и подсчёта индекса PASI его интервал составил от 18,9 до 67,5 балла (в среднем 30,0±2,9). В І группе лёгкое течение псориаза не наблюдалось, среднетяжёлое — у 14 (51,8%), тяжёлое — у 13 (48,1%), во ІІ аналогичные показатели составили 2 (7,7%), 18 (69,2%) и 6 (23,1%).
Всем пациентам с ПС проводили стандартное лечение в условиях дерматологического стационара, получали дезинтоксикационную, гипосенсибилизирующую терапию, гепатопротекторы, витамины, цитостатики (метотрексат), физиотерапевтическое лечение, наружную терапию. Больным с ПС и ГБ после обследования назначалась традиционная адекватная антигипертензивная терапия с персональным подбором патогенетически обоснованного лечения.
Определение IL-1a, TNF-a, VEGF-A, Caspase-8 в сыворотке крови проводили методом непрямого твёрдофазного иммуноферментного анализа с использованием наборов фирмы Bender MedSystems GmbH (Австрия) согласно инструкциям к наборам в условиях in vitro. Результаты количественного определения IL-1a, TNF-a, VEGF-A выражались в пг/мл, а Caspase-8 — в нг/мл.
Определение нитротирозина в сыворотке крови проводили методом непрямого твёрдофазного иммуноферментного анализа с использованием набора фирмы Hycult biotech (Нидерланды) согласно инструкции к набору в условиях in vitro. Концентрация нитротирозина выражалась в нмоль/мл.
Статистический анализ выполнили с использованием пакетов прикладных программ «STATISTICA® for Windows 6.0» (StatSoft Inc, № лицензии AXXR712D833214FAN5), «Microsoft Excel 2003», «SPSS 15». Для всех видов анализа статистически значимыми считали различия при р<0,05. Использовали непараметрические методы анализа данных, исходя из характеристики распределения. Результаты представлены в виде медианы (Ме) и межквартильного диапазона (25−75 перцентилей).
Оценку степени взаимосвязи между парами независимых признаков, выраженных в количественной шкале, осуществили с помощью ранговой корреляции Spearman.
Результаты и их обсуждение Псориатическая болезнь протекает в условиях дефицита факторов антиоксидантной системы, и нехватка этих факторов значительно усугубляется в период обострения и у длительно болеющих пациентов. Как результат этого процесса, происходит активация свободно-радикального окисления, развитие перекисного окисления липидов и окислительная модификация белков, нарушение структурно-функциональных свойств клеток. Степень дисбаланса в системе «прооксиданты-антиоксиданты» определяется длительностью процесса. Со временем организм формирует компенсаторно-приспособительные механизмы, что приводит к мобилизации антиоксидантных ресурсов, но при этом уровень свободно-радикального окисления всё равно остаётся на достаточно высоком уровне.
Результатом дисбаланса прооксидантных и антиоксидантных факторов является увеличение скорости пролиферации эпидермиса, его дисфункция из-за нарушенной кератинизации и барьерных функций, а это в свою очередь усиливает воспаление и стимулирует деление клеток, приводя к образованию большого количества кератиноцитов. Воспалительный же процесс также приводит к накоплению продуктов пероксидации, что ещё больше усугубляет течение псориаза [17].
В нормальном состоянии эндотелиоциты не секретируют фактор роста VEGF-A. Однако после стимуляции происходит активная продукция VEGF-A клетками эндотелия, в частности для артериальной гипертензии характерен высокий уровень экспрессии VEGF-A.
Рассмотрим полученные значения VEGF-A у обследованных в группах пациентов (табл. 1).
Проведённый анализ результатов ИФА в зависимости от наличия или отсутствия ГБ показал: в группе больных с ПС и ГБ уровень сигнального белка васкулогенеза был максимальным, составляя 694,44 (567,36−829,87) пг/мл, — на 48,27% (p<0,01) статистически значимо выше, чем у лиц с ПС, и более чем в 5 раз (p<0,01) превосходил показатели группы больных с ГБ. Норма у практически здоровых лиц — до 182 пг/мл (С. Ю. Басилайшвили, В. И. Стариков, 2015). В то же время у больных с ПС без коморбидности уровень этого фактора роста эндотелия сосудов был выше в 3,5 раза (p<0,01) при сопоставлении с пациентами группы ГБ, у которых рассматриваемый показатель не превышал 300 пг/мл, медиана составила 132,6 пг/мл, колеблясь от 24,82 до 456,8 пг/мл. Это указывает на наибольшую активность ангиогенеза именно у пациентов при сочетании ПС и ГБ, что может иметь следующие патогенетические предпосылки: при ПС, как и при ГБ, значительно усиливается ангиогенез, который реализуется за счёт усиленной пролиферации эндотелиальных клеток.
Таблица 1 Концентрационные значения VEGF-А у обследованных лиц (Ме (25−75 перцентилей))
Показатель, единицы измерения. | Больные ПС в сочетании с ГБ (n=27). | Больные ПС (n=26). | Больные ГБ (n=49). | |
VEGF-А, пг/мл. |
|
|
| |
Примечания: * - р<0,01 при сравнении с группой пациентов с ПС; # - р<0,01 при сравнении с группой с ГБ.
Процесс ангиогенеза очень многофакторный и многокомпонентный, состоит не только из процесса пролиферации клеток эндотелия, но и из инвазии этих же эндотелиальных клеток в сосудистый матрикс, образования новых капиллярных трубок, а весь этот процесс регулирует внеклеточный матрикс и особые адгезивные рецепторы внеклеточного матрикса — интегрины, Е-селектин, тимидинфосфорилазы, ангиопоэтины. В норме факторы, которые стимулируют и тормозят ангиогенез, находятся в равновесии, но, по нашему мнению, при ряде заболеваний, таких как ПС и ГБ, происходит разбалансирование этой сложной системы, что и приводит к сверхстимуляции роста сосудов.
При ПС источником цитокинов ангиогенеза являются активированные кератиноциты, которые и продуцируют интерлейкины 1, 6, 8, фактор некроза опухоли а, трансформирующий фактор роста (TGF), фактор роста эндотелия сосудов (VEGF-А). Как показывают исследования последних лет, самым активным стимулятором ангиогенеза является VEGF-А. Доказано, что VEGF-А является стресс-зависимым белком, а регулируется он кислородои глюкозозависимыми белками как ответ организма на нехватку кислорода и другие патологические процессы.
Таким образом, не подлежит сомнению важнейшая роль VEGF-А в патогенезе псориаза, что и подтверждается высокими значениями данного маркера у обследованных нами пациентов как с коморбидным состоянием, так и с монопатологией. Корригируя уровни VEGF-А у больных ПС и ГБ, можно оптимизировать проводимое стандартное лечение и получить стойкую ремиссию у пациентов [20].
Изменение физиологического состояния клетки приводит к изменению маркеров апоптоза, каспаз. Каспаза синтезируется в клетке первоначально в виде неактивного профермента, образование активных форм каспаз инициируется протеолитическим расщеплением. Каспазы участвуют в изменении всех частей клетки при апоптозе, расщепляя незначительную фракцию белков, однако достаточную для полной разборки клетки на апоптозные тельца. Каспазы обусловливают такой важный признак апоптоза, как фрагментация ДНК, которая осуществляется ДНК-фрагментирующими факторами, активированными каспазозависимыми эндонуклеазами. Каспаза-8 является классической инициирующей каспазой при передаче сигналов от рецепторов апоптоза Fas, TNF, DRI [21,22].
Апоптоз играет важную роль в обеспечении гомеостаза тканей, осуществляет защитную функцию, элиминируя аутореактивные Т-лимфоциты-киллеры и ограничивая тем самым деструкцию собственных клеток и тканей организма. Апоптоз зрелых лимфоцитов, преимущественно Т-хелперов, является средством регуляции интенсивности и продолжительности иммунного ответа.
Для оценки взаимосвязи VEGF-А с параметрами нитрозирующего стресса (нитротирозин) и цитокиновым профилем мы провели корреляционный анализ по P. Spearman ® в каждой из отдельный подгрупп (рис. 1).
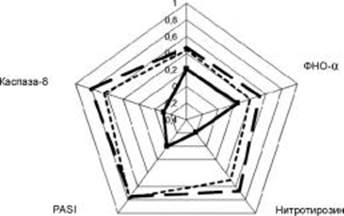
Рис. 1. Корреляционная матрица взаимозависимости VEGF-А с другими показателями по группам больных.
Рассчитанная оценка степени взаимосвязи между парами независимых признаков, выраженных в количественной шкале согласно представленной корреляционной матрице (рис. 1) и данным коэффициентов корреляции, оказалась статистически значимой у пациентов с ПС при наличии ГБ и свидетельствовала о наличии достоверной прямой взаимозависимости экспрессии VEGF-А и параметров нитрозирующего стресса, выраженностью апоптоза и иммуно-воспалительной активностью у этих больных. В группе ПС без коморбидности взаимозависимость также была достоверной, но менее статистически значимой и менее выраженной. У пациентов с ГБ корреляционные коэффициенты оказались разнонаправленными в паре.
Выводы
- 1. Сочетание псориаза и ГБ характеризуется усилением экспрессии ряда маркеров, таких как провоспалительные цитокины (фактор некроза опухоли а, интерлейкин 1а), эндотелиальный сосудистый фактор роста (VEGF-А), показатели нитрозирующего стресса (нитротирозин), индикаторы активации апоптотических процессов (каспаза-8), уровень которых значительно превосходит аналогичные показатели у пациентов без сочетанной патологии (наличие только ГБ или только псориаза).
- 2. Наиболее показательным в группе больных с сочетанной патологией (ГБ и ПС), свидетельствующим о тяжести ПС, оказался уровень сигнального белка васкулогенеза (VEGF-А), который более чем в 5 раз превосходил аналогичный показатель группы больных с ГБ и в 1,5 раза превышал аналогичный показатель в группе пациентов, страдающих лишь псориазом.
Данные свидетельствуют о необходимости разработки и оценки эффективности новых подходов к лечению больных как с изолированными ПС и ГБ, так (и особенно) с сочетанием этих двух заболеваний.
- 1. Иммунные механизмы псориаза. Новые стратегии биологической терапии / А. А. Кубанова, А. А. Кубанов, Дж.Ф. Николас и др. // Вестник дерматологии и венерологии. — 2010. — № 1. С. 35−47.
- 2. Psoriasis, the liver, and the gastrointestinal tract / P. Gisondi, M. Del Giglio, A. Cozzi // Dermatol. Ther. — 2010. — Vol. 23. — № 2. — P. 155−159.
- 3. Boehncke W.H. Research in practice: the systemic aspects of psoriasis / W.H. Boehncke, S. Boehncke // J. Dtsch. Dermatol. Ges. — 2008. — Vol. 6. — P. 622−625.
- 4. Вульгарный псориаз: особенности патогенеза и терапии / B. Сухарев, РН. Назаров, М. И. Юрчик, А. В. Патрушев // Российский журнал кожных и венерических болезней. — 2009. № 2. — С. 23−26.
- 5. Мак R.K. Progress in understanding the immunopathogenesis of psoriasis / R.K. Мак, С. Hundhausen, F.O. Nestle // ActasDermoSifiliograficas. — 2009. — Vol. 100. — Suppl. 2. — P. 2−13.
- 6. Курдина М. И. Комплексная оценка безопасности лечения больных псориазом химерными моноклональными антителами к ФНО-а / М. И. Курдина, Л. А. Макаренко // Тезисы научных работ III Всероссийского конгресса дерматовенерологов. — М., 2009. — С. 45.
- 7. Psoriasis, the liver, and the gastrointestinal tract / P. Gisondi, M.D. Giglio, A. Cozzi, G. Girolomoni // Dermatolodic Therapy. 2010. — Vol. 23. — № 2. — P 155−159.
- 8. European S3-Guidelines on the systemic treatment of psoriasis vulgaris / D. Pathirana, A.D. Ormerod, P. Saiag, et al. // JEADV.
- 9. 2009. — Vol. 23. — Suppl. 2. — P. 70.
- 10. Peternel S. Immunopathogenesis of psoriasis: focus on natural killer T cells / S. Peternel, M. Kastelan // J. Eur. Acad. Dermatol. Venereol. — 2009. — Vol. 23. — № 10. — P. 1123−1127.
- 11. Foxp3+ regulatory T cells and related cytokines differentially expressed in plaque vs. guttate psoriasis vulgaris / K.X. Yan, X. Fang, L. Han et al. // Br. J. Dermatol. — 2010. — Vol. 163. — P. 48−56.
- 12. Джериева И. С. Артериальная гипертензия и метаболические нарушения / И. С. Джериева, Н. И. Волкова // Клиническая медицина. — 2010. — Т. 88. — № 2. — С. 4−8.
- 13. Бунова С. С. Вклад нейрогуморальной дисфункции и повышенной массы тела в течение гипертонической болезни / С. С. Букова // Терапевтический архив. -2009. — Т. 81. — № 5. С. 71−74.
- 14. Эффекты гипотензивной терапии на состояние сосудистой стенки у больных артериальной гипертонией / Н. В. Дроботя,
- 15. Н. С. Долтмурзиева, Э. Ш. Гусейнова, А. А. Дроботя // Клиническая фармакология и терапия. -2010. — Т. 19. — № 4. — С. 30−32.
- 16. Ligand-binding domain determines endoplasmic reticulum exit of AMP A receptors / S.K. Coleman, T. Moykkynen, S. Hinkkuri et al. // J. Biol. Chem. — 2010. — Vol. 285. — Issue 46. — P. 36 032−36 039.
- 17. Functional muscle regeneration with combined delivery of angiogenesis and myogenesis factors / C. Borselli, H. Storrie, F. Benesch-Lee et al. // ProcNatlAcadSci USA. — 2010. — № 107(8). Р 3287−92.
- 18. Rebuilding the damaged heart: the potential of cytokines and growth factors in the treatment of ischemic heart disease / N. Beohar, J. Rapp, S. Pandya, D.W. Losordo // J Am CollCardiol. — 2010. № 56(16). — Р 1287−97.
- 19. Elevation of serum epidermal growth factor and interleukin 1 receptor antagonist in active psoriasis vulgaris / K.S. Anderson, S. Petersson, J. Wong et al. // Br. J. Dermatol. — 2010. — Vol. 163. № 5. — P. 1085−89.
- 20. Матушевская Ю. И. Оценка эффективности терапии больных тяжелыми формами псориаза с применением генно-инженерного биологического препарата инфликсимаб на основании клинических и иммунологических показателей: автореф. дис. на соискание ученой степени к.мед.н. / Ю. И. Матушевская. М., 2009.
- 21. Treatments for psoriasis and the risk of malignancy / R.V. Patel, L.N. Clark, M. Lebwohl, J.M. Weinberg // J Am AcadDermatol. 2009. — Vol. 60. — P. 100−117.
- 22. Further genetic evidence for three psoriasis risk genes: ADAM33, CDKAL1, and PTPN22 / Y. Li, W. Liao, M. Chang et al. // J. Invest. Dermatol. — 2009. -Vol. 129. — P. 629−34.
- 23. Кетлинский С. А. Цитокины / С. А. Кетлинский, A.C. Симбирцев. — СПб: Фолиант, 2008. — 552 с.
- 24. Heat shock protein 90 inhibitor induces apoptosis and attenuates activation of hepatic stellate cells / S.J. Myung, J.H. Yoon, H. Kim et al. // J PharmacolExpTher. -2009. — Vol. 330. — № 1. P. 276−282.
References.
- 1. Kubanova, A. A., Nikolas, J. F., Puig, L., Prince, J., Katunina, O. R., & Znamenskaya, L. F. (2010) Immunnye mekhanizmy psoriaza. Novye strategii biologicheskoj terapii [Immune mechanisms of psoriasis. New strategies of biotherapy]. Vestnik dermatologii i venerologii, 1, 35−47. [in Russian].
- 2. Gisondi, P, Del Giglio, M., Cozzi, A., & Girolomoni, G. (2010) Psoriasis, the liver, and the gastrointestinal tract. Dermatol. Ther., 23(2), 155−159. doi: 10.1111/j.1529−8019.2010.1 310.x.
- 3. Boehncke, W. H., & Boehncke, S. (2008) Research in practice: the systemic aspects of psoriasis. J. Dtsch. Dermatol. Ges., 6, 622−625. doi: 10.1111/j.1610−0387.2008.6 785.x.
- 4. Sukharev, A. V, Nazarov, R. N., Yurchik, M. I., & Patrushev, A. V (2009) Vul’garnyj psoriaz: osobennosti patogeneza i terapii [Psoriasis vulgaris: the specific features of its pathogenesis and therapy]. Rossijskij zhurnal kozhnykh i venericheskikh boleznej, 2, 23−26. [in Russian].
- 5. Mak, R. K., Hundhausen, S., & Nestle, F. O. (2009) Progress in understanding the immunopathogenesis of psoriasis. ActasDermoSifiliograficas, 100(2), 2−13.
- 6. Kurdina, M. I., & Makarenko, L. A. (2009) Kompleksnaya ocenka bezopasnosti lecheniya bol’nykh psoriazom khimernymi monoklonal’nymi antitelami k FNO-a [Integrated Safety Assessment of treatment of psoriasis patients with chimeric monoclonal antibody to TNF-alpha]. Abstracts of Papers of the 3rd All-Russian Congress of dermatologists, (S. 45). Moscow. [in Russian].
- 7. Gisondi, P., Giglio, M. D., Cozzi, A., & Girolomoni, G. (2010) Psoriasis, the liver, and the gastrointestinal tract. Dermatolodic Therapy., 23(2), 155−159. doi: 10.1111/j.1529−8019.2010.1 310.x.
- 8. Pathirana, D., Ormerod, A. D., Saiag, P., Smith, C., Spuls, P., & Nast, A. (2009) European S3-Guidelines on the systemic treatment of psoriasis vulgaris. JEADV, 23(2), 70. doi: 10.1111/j.1468- 3083.2009.3 389.x.
- 9. Peternel, S., & Kastelan, M. (2009) Immunopathogenesis of psoriasis: focus on natural killer T cells. J. Eur. Acad. Dermatol. Venereol., 23(10), 1123−1127. doi: 10.1111/j.1468−3083.2009.3 292.x.
- 10. Yan, K. X., Fang, X., Han, L., Zhang, Z. H., Kang, K. F., Zheng, Z. Z., & Huang, Q. (2010) Foxp3+ regulatory T cells and related cytokines differentially expressed in plaque vs. guttate psoriasis vulgaris. Br. J. Dermatol, 163, 48−56. doi: 10.1111/j.1365- 2133.2010.9 742.x.
- 11. Dzherieva, I. S., & Volkova, N. I. (2010) Arterial’naya gipertenziya i metabolicheskie narusheniya [Arterial hypertension and metabolic disorders]. Klinicheskayamedicina, 88(2), 4−8. [in Russian].
- 12. Bunova, S. S. (2009) Vklad nejrogumoral’noj disfunkcii i povyshennoj massy tela v techenie gipertonicheskoj bolezni [Contribution of neurohumoral dysfunction and overweight to the course of essential hypertension]. Terapevticheskijarkhiv, 81(5), 71−74. [in Russian].
- 13. Drobotya, N. V, Doltmurzieva, N. S., Gusejnova, E'. Sh., & Drobotya, A. A. (2010) E’ffekty gipotenzivnoj terapii na sostoyanie sosudistoj stenki u bol’nykh arterial’noj gipertoniej [The effects of antihypertensive therapy on the vascular wall in hypertensive patients]. Klinicheskaya farmakologiya i terapiya, 19(4), 30−32. [in Russian].
- 14. Coleman, S. K., Moykkynen, T., Hinkkuri, S., Vaahtera, L., Korpi, E. R., Pentikainen, O. T., & Keinanen, K. (2010) Ligand-binding domain determines endoplasmic reticulum exit of AMP A receptors. J. Biol. Chem, 285(46), 36 032−36 039. doi: 10.1074/jbc. M110.156 943.
- 15. Borselli, C., Storrie, H., Benesch-Lee, F., Shvartsmana, D., Cezara, Lichtmane, J. W., et al. (2010) Functional muscle regeneration with combined delivery of angiogenesis and myogenesis factors. ProcNatlAcadSci USA, 107(8), 3287−92. doi: 10.1073/ pnas.903 875 106.
- 16. Beohar, N., Rapp, J., Pandya, S., & Losordo, D. W. (2010) Rebuilding the damaged heart: the potential of cytokines and growth factors in the treatment of ischemic heart disease. J Am CollCardiol, 56(16), 1287−97. doi: 10.1016/j.jacc.2010.05.039.
- 17. Anderson, K. S., Petersson, S., Wong, J., Shubbar, E, Lokko, N. N., Carlstrom, M., & Enerback, C. (2010) Elevation of serum epidermal growth factor and interleukin 1 receptor antagonist in active psoriasis vulgaris. Br. J. Dermatol., 163(5), 1085−89. doi: 10.1111/j.1365−2133.2010.9 990.x.
- 18. Matushevskaya, Yu. I. (2009) Ocenka e’ffektivnosti terapii bol’nykh tyazhelymi formami psoriaza s primeneniem genno-inzhenernogo biologicheskogopreparata infliksimab na osnovanii klinicheskikh i immunologicheskikh pokazatelej (Avtoref. dis… kand. med. nauk). [Estimation of efficiency treatment of patients with severe psoriasis with the use of genetically engineered biological drug infliximab based on clinical and immunological parameters]. (Extended abstract of candidate’s thesis). Moscow. [in Russian].
- 19. Patel, R. V, Clark, L. N., Lebwohl, M., & Weinberg, J. M. (2009) Treatments for psoriasis and the risk of malignancy. J Am Acad Dermatol, 60, 100−117. doi: 10.1016/j.jaad.2008.12.031.
- 20. Li, Y., Liao, W., Chang, M., Schrodi, S. J., Bui, N., Catanese, J J., et al. (2009) Further genetic evidence for three psoriasis risk genes: ADAM33, CDKAL1, and PTPN22. J. Invest. Dermatol, 129, 629−34. doi: 10.1038/jid.2008.297.
- 21. Ketlinskij, S. A., & Simbircev, A. S. (2008) Citokiny[Cytokines]. Saint Petersburg: Foliant. [in Russian].
- 22. Myung, S. J., Yoon, J. H., Kim B. H. Lee, J. H., Jung, E. U., & Lee, H. S. (2009) Heat shock protein 90 inhibitor induces apoptosis and attenuates activation of hepatic stellate cells. J Pharmacol ExpTher., 330(1), 276−282. doi: 10.1124/jpet.109.151 860.
Макурина Г И., к. мед. н., доцент каф. дерматовенерологии и косметологии с курсом дерматовенерологии и эстетической медицины ФПО, Запорожский государственный медицинский университет, E-mail: Этот адрес e-mail защищен от спам-ботов. Чтобы увидеть его, у Вас должен быть включен Java-Script.
Макуріна Г. І., к. мед. н., доцент каф. дерматовенерології та косметології з курсом дерматовенерології та естетичної медицини ФПО, Запорізький державний медичний університет, E-mail: Этот адрес e-mail защищен от спам-ботов. Чтобы увидеть его, у Вас должен быть включен Java-Script.
Makurina G. I., MD, PhD, Associate Professor, Department of Dermatovenerology and Cosmetology with the Course of Dermatovenerology and Aesthetic Medicine of the Post-graduate Education Faculty, Zaporizhzhia State Medical University, E-mail: Этот адрес e-mail защищен от спам-ботов. Чтобы увидеть его, у Вас должен быть включен Java-Script.
Поступила в редакцию 04.02.2016 г.