Генотипирование лекарственного растения Codonopsisclematidea (Shrenk) dark, произрастающего на территории Юго-Восточного Казахстана

Исходя из изложенного выше можно говорить о перспективности и актуальности изучения популяции C. clematidea (Shrenk) Clark, произрастающей в юго-восточных регионах Казахстана, тем более, что работы поегогенотипированию у нас не проводились. В связи с этим целью данной работы являлись генотипирование казахстанской популяции C. clematidea (Shrenk) Clark для создания и пополнения собственной базы… Читать ещё >
Генотипирование лекарственного растения Codonopsisclematidea (Shrenk) dark, произрастающего на территории Юго-Восточного Казахстана (реферат, курсовая, диплом, контрольная)
Семейство CampanulaceaeJuss. распространено во всем мире и включает большое количество известных лекарственных растений, таких как Platycodongrandiflorum, Codonopsispilosula и Adeno-phoratriphylla. По одним данным это семейство состоит из 50 родов и 800 видов [1−2], а согласно другим источникам — из 40 родов и 600 видов [3] или же из 87 родов и 1950 видов [4]. Такое значительное разногласие среди литературных данных связано с несоответствием всех предыдущих классификаций семейства CampanulaceaeJuss. Более того, нет общего мнения о границе рода, а также в более высших рангах среди главных субразделов семейства. Таксономические проблемы данного семейства могут быть объяснены тем фактом, что все эти ранние классификации имеют более географическую, чем биологическую основу [5].
Виды семейства CampanulaceaeJuss., несмотря на их количество и значение во флоре с умеренным климатом, остаются недостаточно изученными [5]. В Казахстане насчитывается 20 видов растений из этого семейства [6].
Одними из перспективных растений этого семейства являются растения рода Кодонопсис (Co-donopsisWall.). Во флоре СССР [7] указывается, что виды Кодонопсиса произрастают на Дальнем Востоке и в горах Центральной Азии. В Казахстане единственным представителем данного рода является Кодонопсисломоносовидный (C. clematidea (Shrenk) Clark), произрастающий в горах Тянь-Шаня, Памир-Алае и Джунгарском Алатау [8].
Некоторые виды Кодонопсиса издревле используются в народной медицине, например, C. clematidea — азиатский колокольчик «tang-sheng» [3] или корень «Dangshen» [9] в китайской медицине известен как заменитель дорогостоящего корня женьшеня (Panaxginseng) и до сих пор применяется в Китае, Японии и Корее при повышенном кровяном давлении, заболеваниях сердца, при быстрой утомляемости, для укрепления иммунной системы, снижения артериального давления и улучшения аппетита. Благодаря широкому изучению химического состава корнеплодов Кодонопсиса выявлены новые алкалоидные и флавоноидные соединения, тритерпеноиды, сапонины и полиацетиленовые вещества [9−10]. Кроме того, в традиционной медицине Узбекистана при лечении болезней печени используется и надземная часть растений C. clematidea [11]. Алкалоиды кодонопсин и кодо-нопсинин, выделенные из растений C. Clematidea, являются низкотоксичными соединениями и обладают широким спектром фармакологического действия, желчегонный эффект которых в два раза выше, чем у часто используемых в медицине берберина и флавина. В настоящее время большое количество препаратов, основанных на кодонопсине, применяется для профилактики и лечения болезней печени и желчного пузыря, а также токсического гепатита.
В основном корень Dangshen получают из трех видов Кодонопсиса: Codonopsispilosula (Franch.) Nannf., C. pilosulaNannf. var. modesta (Nannf.) L.T.Shenили C. tangshenOliv. [12]. Однакодругиепятьвидов C. tubulosaKom., C. subglobosaW.W.Smith, C. clematidea (Shrenk) Clark, C. canescensNannf. и C. lanceolata (Sieb. et Zucc.) Trautv. также могут являться заменителями лекарственного корня Кодо-нопсиса [9].
В Китае водный горячий экстракт из корней C. lanceolata стал применяться более тысячи лет назад при лечении мужской половой стерильности и импотенции, а также использовался как пищевая добавка в различные блюда. Недавно было показано, что биологически активные компоненты C. lanceolata обладают антиоксидантным [13] и цитотоксическим действием против раковых клеток [14]. Корнеплоды растений C. tangshenOliv., или Chuan-Danshen, также хорошо известны в традиционной китайской медицине тем, что иногда используются как заменители корня женьшеня и обладают тонизирующим действием [15]. C. pilosula (Franch.) Nannf. применяется в китайской народной медицине при диспепсии, бронхитах, кашле, спазмах и воспалениях, а также используется в пищу [16].
Однако известны случаи отравления при применении недоброкачественных растительных препаратов и добавок, что, в свою очередь, привело к волне исследовательских работ с применением мо-лекулярно-генетических методов анализа с целью быстрой идентификации образцов растительного происхождения [17]. На сегодняшний день одним из популярных методов при идентификации, гено-типировании и изучении филогенетического родства между различными видами является метод сек-венирования ДНК.
Известно, что различные регионы генома эволюционируют с различной скоростью, что пригодно при идентификации разных таксономических уровней. Регионы, не кодирующие белки, находятся под меньшим селективным давлением, хотя иногда могут иметь более вариабельные участки. По этим вариабельным участкам возможна дифференциация различных близкородственных организмов. Так, общеиспользуемыми при секвенировании локусами генома являются гены, кодирующие рибо-сомальную РНК (rDNA), и гены, находящиеся в митохондриальной и хлоропластной ДНК. Проведена расшифровка нуклеотидных последовательностей rDNA растений, используемых в китайской медицине, таких как виды Panaxspecies, Eucommiaulmoides (Duzhong), Cordyceps (Dongchongxiacao) species, Dendrobium (Shihu) species, Myospalaxbaileyi и Ligusticumchuanxiong (Chuanxiong). Кроме того, ряд авторов с целью молекулярно-филогенетического исследования всего семейства Campanu-laceae указывают на секвенирование внутреннего транскрибируемого участка (internaltranscribedspacer (ITS)) рибосомальной ДНК (rDNA), интронной части генов matK/trnK [18], а также хлоропла-стной ДНК (cpDNA) [19]. Результаты секвенирования участков ITSI и ITSII rDNA четырех видов Co-donopsisWall. показали высокую гомологию, но не идентичность [20].
Исходя из изложенного выше можно говорить о перспективности и актуальности изучения популяции C. clematidea (Shrenk) Clark, произрастающей в юго-восточных регионах Казахстана, тем более, что работы поегогенотипированию у нас не проводились. В связи с этим целью данной работы являлись генотипирование казахстанской популяции C. clematidea (Shrenk) Clark для создания и пополнения собственной базы данных о нуклеотидных последовательностях ДНК лекарственных растений Казахстана на основе секвенирования внутреннего транскрибируемого участка (internaltranscribedspacer (ITS)) ITSI и ITSII рибосомальной ДНК (rDNA) и сравнительный анализ полученной нуклеотидной последовательности с референсными последовательностями через базу данных GenBank.
Материалы и методы Образцы растений C. clematidea (Shrenk) Clark собраны в Аксайском ущелье Алма-Атинской области.
Выделение ДНК проводилось по СТАВ-методу [21] с некоторыми модификациями. Измерение концентрации выделенной ДНК было проведено на приборе NanoDrop 1000 (ThermoScientific, США).
Амплификация проводилась с использованием специфичных к региону ITSI и ITSII праймеров: forward ITSI и reverse ITSIV (Синтол, Россия), любезно предоставленных лабораторией клеточной селекции и биотехнологии НЦБ КН МОН РК. Полимеразно-цепная реакция (ПЦР) проведена на приборе DNA EngineTetrad 2 Cycler (Bio-Rad, США). Реакционная смесь состояла: 10 х раствор dNTPs (2 mmol/l каждого нуклеотида) 2,5pl, 10 х ПЦР буфер 2,5 pl, ДНК мишень (0,02 pg/pl) 5 pl, Taq ДНК полимераза 1U, 10 pmol/plпраймеры по 0,5 pl. Общий объем смеси доведен до 25 pl водой, свободной от нуклеаз. Температурные условия амплификации следующие: преденатурация при 95 °C в течение 5 мин, денатурация при 95 °C 30 сек, отжиг при 55 °C 1 мин и элонгация при 72 °C 1 мин. Всего режим амплификации состоял из 35 циклов. Последняя элонгация проводилась при 72 °C в течение 7 мин. Для визуализации ПЦР-продуктов проведен электрофорез в 2%-ном агарозном геле при 120 V.
Элюированные из геля и очищенные ПЦР-продукты были секвенированы с помощью набора BigDyeterminator v3.1 sequencingkit (AppliedBiosystems, США) на приборе 3730 DNA analyzer (AppliedBiosystems, США) согласно протоколу фирмы-производителя. Анализ результатов секвени-рования осуществлен с использованием программы Vector NTI Advance 10 и базы данных GenBank NCBI. Построение дендрограммы проведено с помощью метода NeighborJoining. Все эксперименты проведены в 2−3 повторностях.
Результаты На электрофореграмме (рис.1) видно, что длина продукта амплификации составляет ~ 750 пар нуклеотидов (п.н.).
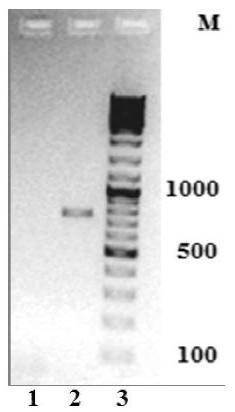
Рис. 1. Электрофоретическое разделение продуктов амплификации в 2%-ном агарозном геле: 1 — негативный контроль (Н2О); 2 — ПЦР-продукт длиной ~ 750 п.н.; 3 — маркеры молекулярного веса, п. н.
Рисунок 2 демонстрирует часть нуклеотидной последовательности ITS региона rDNA, полученной при ПЦР с праймеромforward ITSI.
Генотипирование лекарственного растения. Сравнительный анализ, проведенный через базу данных GenBank (см. табл.), показал, что полученная нуклеотидная последовательность ITSI и ITSII регионов rDNA растений C. clematidea идентична на 97% секвенсам следующих видов: C. kawakamii, C. tangshen, C. pilosula и C. pilosulavar. modesta, а также видам C. lanceolata и C. javanicasubsp. japonica с идентичностью на 93 и 89% соответственно.
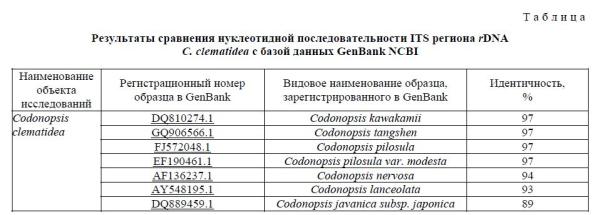
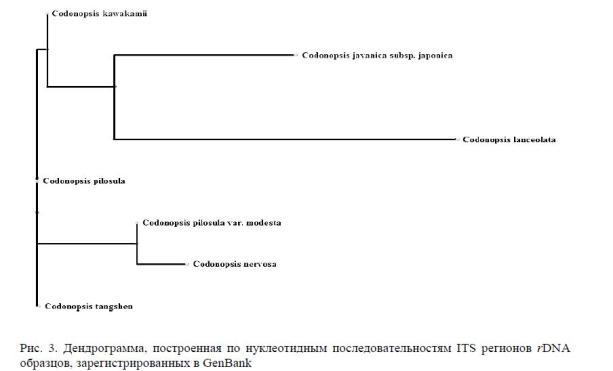
Построение дендрограммы (рис. 3) по нуклеотидным последовательностям ITS регионов rDNA образцов, зарегистрированных в GenBank, позволяет видеть, что виды Кодонопсиса C. kawakamii, C. tangshen, C. pilosula и C. pilosulavar. modesta имеют близкородственное положение и от вида C. kawakamii отходят отдельной и более отдаленной ветвью C. lanceolata и C. javanicasubsp. japonica.
Делая выводы, отметим, что отсутствие данных о нуклеотидной последовательности C. cle-matidea (Shrenk) Clark, вероятно, обусловлено отсутствием соответствующих зарегистрированных последовательностей в использованной нуклеотидной базе GenBank NCBI. Кроме того, по некоторым данным установлено, что отдельные виды Codonopsisspp. невозможно дифференцировать по ITS региону рибосомальной ДНК, так как данная последовательность является высоко консервативной [22].
Нуклеотидная база данных GenBank NCBI (США) является свободно-доступной и одной из больших баз данных, наряду с такими, как EMBL (Европа) и DDBJ (Япония). Однако эти базы не включают информацию, хранящуюся и выдаваемую на платной основе в частных базах данных, которые зачастую создаются при различных университетах. Известно, что результаты, полученные на большей базе данных, обладают большей биологической значимостью. Поэтому представляется необходимым создание и пополнение собственной базы данных о нуклеотидных последовательностях ДНК лекарственных растений Казахстана и их генотипирование по различным локусам генома в целях лучшего понимания сходства организмов и их взаимного расположения на эволюционном дереве. Перспектива видится в развитии молекулярно-генетических методов, основанных на сравнении их полных геномов, что на сегодня становится вполне возможным.
генотипирование лекарственный растение нуклеотидный.
- 1. Lammers T.G. Circumscription and phylogeny of the Campanulales // Ann. MissouriBot. Gard. — 1992. — 79. — P. 388 413.
- 2. Takhtajan A.L. Diversity and Classification of Flowering Plants. — New York: Columbia Univ. Press,
- 3. Aripova S.F. Alkaloid content of clematidea // Chemistry of natural compounds. — 1996. — Vol. 32. — № 4. — P. 564 566.
- 4. Perveen A., QaiserM. Pollen Flora of Pakistan —Campanulaceae // Tr. J. of Botany. — 1999. — Vol. 23. — P. 45−51.
- 5. Shulkina T.V., Gaskin J.F., and Eddie W. M.M. Morphological studies toward an improved classification of Campanulaceaes.str. // Ann. Missouribot. Gard. — 2003. — 90. — P. 576−591.
- 6. Павлов Н. В. Растительное сырье Казахстана — М.-Л., 1947. — С. 459.
- 7. Флора СССР. Т. 24. — М.-Л.: Академия наук, 1957.
- 8. Иллюстрированный определитель растений Казахстана. — Алма-Ата: Наука КазССР, 1972. — С. 304.
- 9. Songlin Li, Quanbin Han, ChunfengQiao, Jingzheng Song, Chuen Lung Cheng and Hongxi Xu. Chemical markers for the quality control of herbal medicines: an overview // Chinese Medicine. — 2008. — 3. — № 7. — P. 1−16.
- 10. Li C., Xu H.X., Han Q.B., Wu T.S. Quality assessment of Radix Codonopsis by quantitative nuclear magnetic resonance // J. Chromatogr A. — 2009. — Vol. 1216. — № 11. — Р. 2124−2149.
- 11. Ishida S., Okasaka M., Ramos F., Kashiwada Y., Takaishi Y., Kodzhimatov O.K., Ashurmetov O. New alkaloids from the aerial parts of Codonopsisclematidea // J.Nat.Med. — 2008. — 62. — P. 236−238.
- 12. Chinese Pharmacopoeia Commission: Pharmacopoeia of the People’s Republic of China Volume— Beijing: People’s Medical Publishing House, 2005. — Р. 197.
- 13. Soo-Hyun Kim, Hyun-Jin Choi, Hyun-Taek Oh, Mi-Ja Chungl, Cheng-Bi Cui2, and Seung-Shi Ham. Cytoprotective Effect by Antioxidant Activity of Codonopsislanceolata and Platycodon grandiflorum Ethyl Acetate Fraction in Human HepG2 Cells // Korean J. Food Sci. Technol. — 2008. — 40. — № 6. — P. 696−701.
- 14. Lee K.-W., Jung H.-J., Park H.-J., Kim D.-G., Lee J.-Y., und Lee K.-T. b-D-Xylopyranosyl-(13) — b-D-glucuronopyranosylEchinocystic Acid Isolated from the Roots of Codonopsislanceolata Induces Caspase-Dependent Apoptosis in Human Acute Promyelocytic Leukemia HL-60 Cells // Biol. Pharm. Bull. — 2005. — 28. — № 5. — Р. 854−859.
- 15. Tsai T.-H. and Lin L.-Ch. Phenolic glycosides and pyrrolidine alkaloids from Codonopsistangshen // Chem. Pharm. — 2008. — Vol. 56. — № 11. — P. 1546−1550.
- 16., Zhao Y., Ruan Y., and Yang Y. Development and Application of a Capillary Electrophoretic Method for the Composition Analysis of a Typical Heteropolysaccharide from CodonopsispilosulaNannf. // Biol. Pharm. Bull. — 2008. — Vol. 31. — № 10. — Р. 1860−1865.
- 17. Pui Ying Yip, Chi Fai Chau, Chun Yin Mak and Hoi Shan Kwan. DNA methods for identification of Chinese medicinal materials // Chinese Medicine. — 2007, 2:9. — Р. 234−253.
- 18. Eddie, W. M. M. A Global reassessment of the Generic Relationships in the Bellflower Family (Campanulaceae). D. Thesis, University of Edinburgh. — 1997), генаrbcL (Cosner, M. E., Jansen R. K. and Lammers T.G. Phylogenetic relationships in the Campanulales based on rbcL sequences // Pl. Syst. Evol. — 1994. — Vol. 190. — P. 79−95.
- 19. Eddie W. M.M., Shulkina T., Gaskin J., Haberle R.C., and Jansen R.K. Phylogeny of Campanulaceae s. str. inferred from its sequences of nuclear ribosomal DNA // Ann. MissouriBot. Gard. — 2003. — 90. — P. 554−575.
- 20. Fu R.Z., Wang J., Zhang Y.B., Wang Z.T., But P.H., Li N., Shaw P.C. Differentiation of medicinal Codonopsis species from adulterants by polymerase chain reaction-restriction fragment length polymorphism // Planta Medica. — 1999. — Vol. 65. —№ 7. — P. 648−650.
- 21. Doyle J.J. and Doyle J.L. A rapid isolation procedure for small quantities of fresh leaf tissue // Phytochem. Bull. Bot. Soc. Amer. — 1987. — 19. — P. 11−15.
- 22. Zhang Y.-B., Shaw P.-C., Sze C.-W., Wang Z.-T. and Tong Molecular Authentication of Chinese Herbal Materials // Journal of Food and Drug Analysis. — Vol. 15. — № 1. — 2007. — P. 1−9.