Ионные реакции в растворах электролитов

Равновесие диссоциации слабых электролитов подчиняется закону действующих масс. При повышении температуры равновесие смещается в сторону эндотермического процесса диссоциации, и степень диссоциации увеличивается. При уменьшении концентрации электролита степень диссоциации также увеличивается, так как равновесие смещается в сторону образования большего числа частиц, являющихся в данном случае… Читать ещё >
Ионные реакции в растворах электролитов (реферат, курсовая, диплом, контрольная)
Растворы солей, кислот и оснований проводят электрический ток.
Растворы и расплавы, проводящие электрический ток, а также сами вещества, образующие их, называют электролитами.
Электрическая проводимость растворов известна с XVIII в., но долгое время никто не предполагал, что в растворах имеются свободные заряженные частицы. Теорию электролитической диссоциации веществ выдвинул и обосновал С. Аррениус (1887 г.). Большинство современных ему ученых сначала категорически отвергали существование свободных ионов. Интересно, что важнейшим аргументом, доказывающим наличие ионов в растворах, служит не сам факт электрической проводимости, а характер зависимости проводимости от концентрации электролита. Есть два типа электролитов — сильные и слабые. Удельная электрическая проводимость сильных электролитов возрастает пропорционально концентрации раствора, слабых электролитов — пропорционально квадратному корню из концентрации. Это означает смещение равновесия в направлении процесса объединения ионов в молекулы, и именно этим подтверждается наличие ионов.
Ионы в растворах электролитов относительно свободно двигаются среди молекул растворителя и приобретают направленное движение в электрическом поле. Этим и объясняется электрическая проводимость. Ионы могут быть как одноатомными, так и многоатомными. Заряд иона создается избытком или недостатком электронов относительно суммарного заряда атомных ядер. Величина и знак заряда обозначаются верхним индексом справа от химической формулы: Na+, Са2+, А13+, СИ, СО§", NHJ, СН3СОС>-,[Fe (CN)6]4~. Положительно заряженный ион называют катионом, отрицательно заряженный ион — анионом.
Одноатомные катионы являются производными атомов металлов. Есть и многоатомные катионы, например NHjf — ион аммония, а также комплексные катионы. Большинство обычных анионов — это кислотные остатки. Анионы бинарных кислот и солей — одноатомные частицы. Названия их образуют от элемента с добавлением суффикса «-ид»: С1_ — хлорид, S2- — сульфид. Анионы кислородсодержащих, органических и комплексных кислот и солей представляют собой многоатомные частицы. Обычным суффиксом в их названиях служит «-ат»: SO2- — сульфат, СН3СОО_ — ацетат. Если элемент в анионе кислородсодержащей кислоты находится не в высшей степени окисления, то применяют суффикс «-ит»; анион SO2-(сера четырехвалентная) — сульфит.
Самые многочисленные электролиты — это соли. Они имеют ионные кристаллические структуры, т. е. действительно состоят из заряженных частиц — ионов, связанных силами электростатического притяжения. При растворении в воде ионы переходят из связанного юо состояния в кристалле к свободному (в смысле возможности перемещения) в растворе. Поэтому кристаллы солей, как правило, электричество не проводят, а растворы солей — проводят.
Аналогичным образом построены и гидроксиды металлов, но только в их составе имеется особый анион ОН-, называемый гидроксидом. Основания — это вторая разновидность электролитов.
Третья разновидность электролитов — кислоты. В отличие от солей и гидроксидов металлов они имеют молекулярное строение, и было бы неправильно полагать, что кислота состоит из катионов водорода и анионов кислотного остатка. Свойства кислот как электролитов объясняются способностью частицы Н+ (иначе говоря, протона р+) к переходу от молекулы кислоты к молекуле воды, в результате чего образуются ионы и возникает электрическая проводимость. Можно сказать, что в этом и заключается секрет поведения кислот: в отличие от других водородных соединений они могут отдавать в реакции переноса именно протон. При этом частица, присоединяющая протон, оказывается основанием. Остаток кислоты (анион) после потери протона — тоже основание, так как он может вернуть себе свой протон:
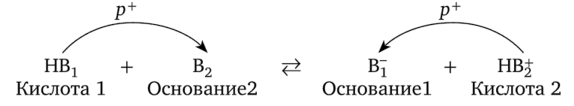
Для примера напишем реакцию переноса протона от азотной кислоты к воде:
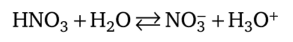
Роль основания здесь играет вода. Ион Н30+ (обычно его обозначают просто Н+) называют ионом гидроксония. Его присутствием в растворах кислот объясняют проявляемые ими специфические свойства, в частности кислый вкус.
Ионы в растворах появляются в результате разных процессов: непосредственно при растворении солей, при переносе протона от кислоты к основанию, при диссоциации некоторых молекул на ионы. Все эти процессы традиционно называют электролитической диссоциацией. Независимо от истинного механизма образования ионов в различных растворах процесс принято записывать в виде реакции диссоциации:
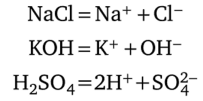
Степень диссоциации (ионизации) а — это отношение числа структурных единиц вещества, образовавших ионы (Л/д), к числу исходных структурных единиц (Л/0):

Различают сильные и слабые электролиты. Сильные электролиты ионизируются практически полностью; можно считать (в первом приближении), что в их растворах отсутствует равновесие между молекулами и ионами, поэтому степень диссоциации, а = 1 (100%) и мало зависит от концентрации. Большинство солей — это сильные электролиты (табл. 4.1). Слабые электролиты принципиально отличаются от сильных наличием в растворе равновесия между молекулами и ионами; их степень диссоциации менее единицы и изменяется обратно пропорционально С½. Самые обычные слабые электролиты — слабые кислоты и основания.
Таблица 4.7
Примеры сильных и слабых электролитов
Класс соединений. | Сильные электролиты. | Слабые электролиты. |
Кислоты. | НС1, HBr, HI, H2S04, HN03, НСЮ3, НСЮф HMn04, CF3SO3H. | Слабые кислоты. |
Основания. | Гидроксиды элементов групп IA (Li—Fr) и НА (Са—Ra). | Слабые основания. |
Соли. | Практически все соли с однозарядными катионами. | Галогениды некоторых металлов (Hg2+, Cd2+, Bi3+); соли многоосновных органических кислот. |
Комплексные соединения. | Комплексы, имеющие внешнюю сферу. | Комплексы, не имеющие внешней сферы. |
Пример 4.13.
Рассчитайте концентрации ионов в растворе хлорида кальция концентрацией 0,04 моль/л.
Хлорид кальция СаС12 — сильный электролит; степень диссоциации близка к 100%. Поэтому согласно реакции диссоциации.
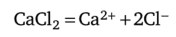
концентрация С (Са2+) = 0,04 моль/л, концентрация С (С1_) = 2 • 0,04 = = 0,08 моль/л.
Как электролитическая диссоциация молекул, так и растворение ионных веществ требуют затраты энергии на увеличение расстояния между электрическими зарядами разного знака. Это процессы эндотермические, их осуществление возможно только при участии растворителя — среды, окружающей молекулы и ионы растворенных веществ.
Из всех растворителей вода в наибольшей мере способствует ионизации. Каждый ион в растворе окружен гидратной (водной) оболочкой, препятствующей соединению ионов в молекулы. Кроме того, вода в качестве среды с высокой диэлектрической постоянной уменьшает силу притяжения между противоположно заряженными ионами приблизительно в 80 раз.
Равновесие диссоциации слабых электролитов подчиняется закону действующих масс. При повышении температуры равновесие смещается в сторону эндотермического процесса диссоциации, и степень диссоциации увеличивается. При уменьшении концентрации электролита степень диссоциации также увеличивается, так как равновесие смещается в сторону образования большего числа частиц, являющихся в данном случае ионами. В этом отношении электролитическая диссоциация подобна газовой реакции, протекающей с увеличением числа частиц. Поэтому, сравнивая относительную силу разных слабых электролитов, следует брать растворы одинаковой концентрации. Равновесие диссоциации слабого электролита смещается в присутствии сильного электролита, один из ионов которого одинаков с ионом слабого электролита.
Пример 4.14.
Пусть уксусная кислота растворена в воде и в растворах хлороводорода и ацетата натрия:
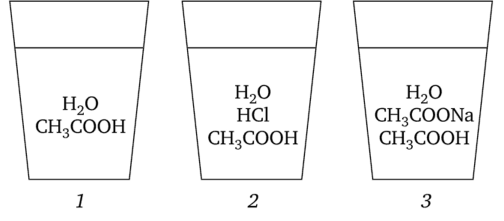
В каком растворе степень диссоциации уксусной кислоты наибольшая при прочих равных условиях?
Сильные электролиты НС1 и CH3COONa дают большое число ионов Н+ и СН3СОО", одинаковых (одноименных) с ионами уксусной кислоты. Поэтому в растворах 2 иЗ равновесие диссоциации уксусной кислоты смещено влево по сравнению с раствором 1, в котором степень диссоциации наибольшая.
Известно, что кислоты бывают одноосновные и многоосновные. Слабые многоосновные кислоты диссоциируют ступенчато. После диссоциации первого иона Н+ образуется анион кислой соли, который тоже диссоциирует, и т. д. На каждой следующей стадии степень диссоциации уменьшается, так как перенос протонов идет сначала от молекул, а потом от анионов с большим отрицательным зарядом:
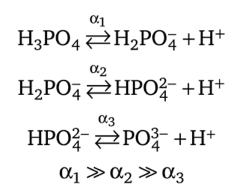
Наибольшее число ионов водорода образуется на первой стадии диссоциации кислоты; дополнительные ионы Н+, появляющиеся на следующих стадиях, можно не учитывать.
Пример 4.15.
В каком растворе степень диссоциации Н2РС>4 (а2) больше при прочих равных условиях: в растворе фосфорной кислоты или в растворе дигидрофосфата калия?
Эти вещества по-разному диссоциируют на первой стадии:
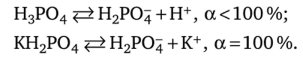
Вторая стадия диссоциации одинаковая:
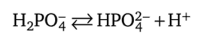
В растворе фосфорной кислоты ионы водорода, образовавшиеся на первой стадии диссоциации, смещают влево равновесие на второй стадии. Поэтому степень диссоциации Н2РС>4 в растворе однозамещенной соли КН2Р04 больше, чем в растворе фосфорной кислоты.
Концентрация ионов водорода представляет собой важную характеристику любого раствора. Ионы водорода Н+ и гидроксила ОНприсутствуют даже в воде вследствие ее ионизации:
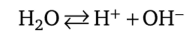
Измерение электрической проводимости воды показало, что в воде С (Н+) = С (ОН-) = 1 • 10-7 моль/л. Эти концентрации соответствуют нейтральной водной среде. Показатель степени при числе 10, взятый без знака «минус», называют водородным показателем и обозначают pH.
В чистой воде и нейтральных водных растворах pH = 7.
Равновесие диссоциации воды смещается влево при растворении кислот и оснований. При растворении кислоты увеличивается концентрация ионов водорода и создается кислая среда, а показатель степени в численном выражении концентрации Н+ уменьшается по абсолютной величине, соответственно уменьшается и pH. Кислой среде в водных растворах соответствует pH < 7.
При растворении основания смещение равновесия диссоциации воды уменьшает концентрацию ионов водорода, причем показатель степени увеличивается по абсолютной величине; это означает увеличение pH. Щелочной среде в водных растворах соответствует pH >7.
В растворах электролитов химические реакции идут с непосредственным участием ионов.
Химическая реакция называется ионной, если в элементарных превращениях участвуют ионы.
Для электролитов характерны реакции ионного обмена.
Возможность протекания реакций ионного обмена определяется образованием слабых электролитов, выделением твердых веществ в осадок или газообразных веществ в виде пузырьков газа.
Обычное уравнение химической реакции, например:
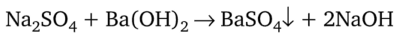
не отражает участия в ней ионов. В действительности, под формулами сильных электролитов в растворах подразумевают свободные ионы:
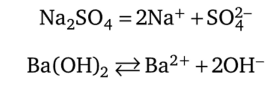
Эти ионы и участвуют в реакции.
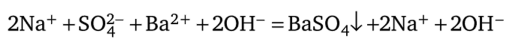
Такое уравнение реакции называют полным ионным уравнением. Ионы бария и сульфат-ионы перешли в связанное состояние, образовав осадок нерастворимой соли. Ионы натрия и гидроксил-ионы в реакции не участвуют и присутствуют в уравнении как слева, так и справа; их следует вычеркнуть, после чего получается сокращенное ионное уравнение реакции:
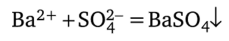
Сокращенное ионное уравнение реакции наиболее правильно отражает сущность происходящего процесса.
Рассмотрим ионную окислительно-восстановительную реакцию. Цинк с одинаковой скоростью (при прочих равных условиях) реагирует с сильными кислотами — хлороводородом и бромоводородом: 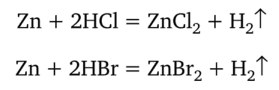
Природа кислотного остатка не влияет на скорость реакции. Обе кислоты в левой части уравнения и соли в правой части присутствуют в растворе только в виде ионов. Напишем реакции с учетом диссоциации веществ:
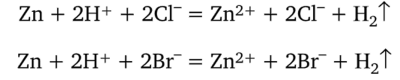
В левой и правой частях уравнения присутствуют не изменившиеся частицы СГ и В г-, которые можно сократить, т. е. исключить из уравнений. После этого два разных уравнения переходят в одно:
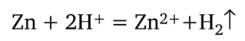
Цинк реагирует и со слабой уксусной кислотой, но в десятки раз медленнее. Более 90% уксусной кислоты находится в растворе в молекулярной форме. Атомы цинка реагируют с имеющимися ионами водорода, концентрация которых уменьшается. Это ведет к смещению равновесия диссоциации уксусной кислоты:
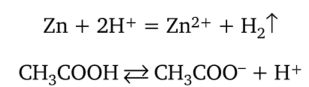
Умножая второе уравнение на коэффициент 2 и складывая эти взаимосвязанные уравнения, получаем суммарное уравнение реакции в ионной форме:
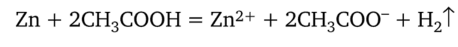
Оказалось, что слабый электролит в ионном уравнении реакции должен быть записан в молекулярной форме.
Твердые и газообразные вещества также могут реагировать с растворами электролитов. Рассмотрим, как записывают уравнения этих реакций в ионной форме.
Порошок не растворимого в воде карбоната кальция реагирует с соляной кислотой с выделением углекислого газа, в результате чего получается бесцветный раствор хлорида кальция:

В данном уравнении исходная соль — электролит, но в кристаллическом состоянии ионы связаны, поэтому нет смысла записывать формулу вещества в ионном виде. Углекислый газ не является электролитом, вода — слабый электролит. Эти два вещества тоже записывают в молекулярной форме. Веществами, распавшимися на ионы в этом растворе, оказались только соляная кислота и хлорид кальция: 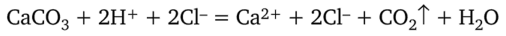
Исключаем из уравнения не участвовавшие в реакции ионы хлора и записываем его в сокращенной форме:
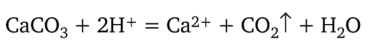
Из рассмотренных примеров следуют правила написания ионных уравнений реакций.
- 1. В ионной форме записывают сильные электролиты, находящиеся в растворе. Неэлектролиты, слабые электролиты и сильные электролиты в виде кристаллических и газообразных веществ записывают в молекулярной форме.
- 2. Для получения ионного уравнения в сокращенной форме из левой и правой частей уравнения исключают одинаковые ионы, так как они не принимали участия в реакции.
- 3. В ионном уравнении суммарный заряд частиц в левой и правой частях должен быть одинаковым.
- 4. При написании ионных уравнений реакций следует руководствоваться списком сильных и слабых электролитов (см. табл. 4.1) и таблицей растворимости.