Уравнение Гендерсона — Гассельбаха

Пример 6.14. Рассчитайте pH раствора, полученного смешиванием 50 мл раствора 0,5 М раствора уксусной кислоты (рКа = 4,76) и 25 мл 0,4 М раствора ацетата натрия. Логарифмируя выражение (6.11), получаем уравнение Гендерсона —Гассельбаха для расчета pH любого двухкомионентного буферного раствора: Если концентрации НА и А" достаточно велики, то кислотность раствора будет определяться единственным… Читать ещё >
Уравнение Гендерсона — Гассельбаха (реферат, курсовая, диплом, контрольная)
В качестве примера возьмем буферную систему А/НА, состоящую из слабой кислоты НА и анионов А-, образующихся при диссоциации какой-либо соли этой кислоты, например натриевой.
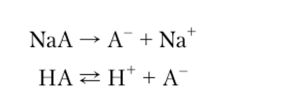
При значительной концентрации одноименного иона А- из соли диссоциация слабой кислоты НА по приведенной выше схеме будет практически подавлена, и буферная система будет состоять из слабой кислоты и сопряженного с ней слабого основания.
Буферное действие такой системы, но отношению к сильной кислоте будет выражаться уравнением.
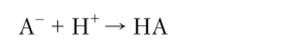
по отношению к сильному основанию — уравнением.
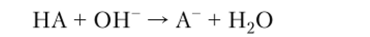
Если концентрации НА и А" достаточно велики, то кислотность раствора будет определяться единственным протолитическим равновесием.
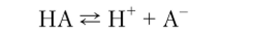
константой которого будет являться соответствующая константа диссоциации (Ка) кислоты НА.
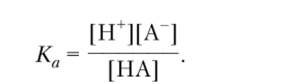
Выражая [Н+] из уравнения (6.10), находим, что концентрация ионов водорода в растворе пропорциональна отношению концентраций сопряженных кислоты и основания:

Логарифмируя выражение (6.11), получаем уравнение Гендерсона —Гассельбаха для расчета pH любого двухкомионентного буферного раствора:

где [А ] — концентрация основания; [НА] — концентрация сопряженной кислоты.
Поскольку оба компонента в буферном растворе находятся в едином объеме, в уравнение Гендерсона — Гассельбаха можно вместо концентраций подставлять количества веществ сопряженных основания и кислоты.
Пример 6.14. Рассчитайте pH раствора, полученного смешиванием 50 мл раствора 0,5 М раствора уксусной кислоты (рКа = 4,76) и 25 мл 0,4 М раствора ацетата натрия.
Если в буферном растворе концентрация основания равна концентрации сопряженной кислоты, pH = рКа. Таким образом можно экспериментально определять рК.х слабых кислот.
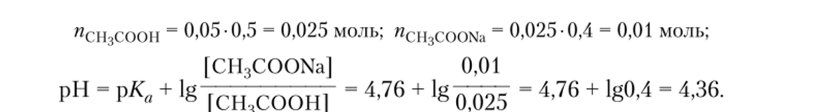
Интервал значений pH рКа ± 1 называется интервалом буферного действия, ему соответствуют соотношения количеств основания и сопряженной кислоты от 10: 1 до 1: 10.
Для буферных систем, включающих производные многоосновных кислот (или многокислотных оснований), величина рКа в уравнении (6.12) должна соответствовать равновесию между компонентами данной буферной системы.
Уравнение Гендерсона —Гассельбаха показывает, что pH буферного.
(c)раствора зависит от соотношения количеств основной и кислотной форм. Значение pH буферного раствора мало меняется при разбавлении в довольно широких пределах (1: 100).
Расчет pH буферных растворов при сильном разбавлении требует учета диссоциации и сопряженной кислоты, и растворителя.
Формулы для расчета двухкомпонентных кислотно-основных буферных систем приведены в табл. 6.5.
Таблица 6.5
Двухкомпонентные кислотно-основные буферные системы.
Буферная система. | Формула для расчета pH. | |
Основание. | Сопряженная кислота. | |
Ацетатная буферная система. | [CHjCOONa]. | |
CH3COONa. | СН3СООН. | р11 рКа + lg[CH3COOH]. |
Гидрокарбонатная буферная система. | … NallCOjI*. | |
NaHC03 | С02Н20. | 1>Н-|>К"*18 s,pco_. |
Карбонатная буферная система. | и гм [ЫагСОз] | |
Na2C03 | NaIlC03 | pH рка2 Jg[NaHC03j. |
Гидрофосфатная буферная система. | [Na2HP04]. | |
Na2HPQ4 | NaH2P04 | pH Рка2 lg [NaH2p0]. |
Аммиачная буферная система. | п г м № 1 | |
NH3 | NH4C1. | pH рХвн* + lg[NH |
Глицин-кислота. | [+NH3CH2COO"] pH Р ках + te^NHjCHjCOOI, |. | |
fNH3CH2COO диполяр! шя форма. | ‘nh3ch2cooh. катионная форма. | |
Глицин-основание. | [NH2CH2COO"] pH Р^"21 + 1Я[+ЫНзСН2СОо 1. | |
NH2CH2COO анионная форма. | +NH3CII2COO д и полярная форма. | |
* 5 — растворимость С02 (ммоль/мм рт. ст.); Рсо2 ~ парциальное давление С02 (мм рт. ст.).