Электролиз водных растворов на инертных электродах

Следует отметить, что аналогично фторидам и кислородсодержащим солям щелочных металлов протекает электролиз сильных кислот и щелочей: электролизу подвергается вода, а названные соединения создают электрическую проводимость среды. Электролиз водного раствора карбоната калия на угольных электродах. Карбонат калия — соль слабой кислоты и сильного основания, подвергается гидролизу, при этом возникает… Читать ещё >
Электролиз водных растворов на инертных электродах (реферат, курсовая, диплом, контрольная)
Особенность электролиза водных растворов электролитов связана с тем, что на электродах всегда присутствует смесь частиц, способных восстанавливаться или окисляться, поэтому необходимо знать, какая из частиц будет участвовать в электродном процессе, а какая — нет. Это довольно сложная проблема, но в практике проведения электролиза были выработаны достаточно простые правила, позволяющие определять, какой из ионов легче восстанавливается или окисляется в конкретных условиях. Эти правила не абсолютны, они определяют большую вероятность какого-либо процесса, но не исключают возможности протекания и других процессов. Разработаны правила преимущественного восстановления катионов (молекул воды) на катоде и окисления анионов (молекул воды) на аноде.
Правила, лимитирующие последовательность восстановления катионов на катоде.
1. Из смеси катионов на катоде легче восстанавливается тот, который имеет больший положительный стандартный электродный потенциал.
Это правило общее, но оно может нарушаться из-за наличия явлений перенапряжения, которое необходимо учитывать в каждом конкретном случае. Так, из смеси катионов цинка, железа и меди первоначально восстанавливается катион меди, затем катион железа и в последнюю очередь — катион цинка (проверьте это утверждение по ряду напряжений). .
Из водных растворов солей металла, начиная с марганца и металлов, стоящих в ряду напряжений правее его (электродный потенциал металла или -1,18 В или положительнее его), на катоде восстанавливаются катионы металла.
Хотя стандартный электродный потенциал железа меньше нуля (-0,44 В), на катоде из водного раствора будут восстанавливаться катионы Fe2+, а не [Н30]+, так как перенапряжение выделения катионов гидроксония очень велико за счет их малой концентрации в растворе.
Несмотря на то что потенциал цинкового электрода меньше нуля, восстанавливаться будут катионы цинка из-за высокого перенапряжения выделения катионов водорода за счет малой их концентрации или по другим причинам.
2. Если имеется смесь катионов металла с потенциалом, более отрицательным, чем —1,18 В, и катионов гидроксония, то из водного раствора восстанавливаются или молекулы воды, или катионы гидроксония.
Из водных растворов солей нельзя получать в свободном состоянии металлы, у которых стандартный электродный потенциал отрицательнее, чем -1,18 В н.в.э. (их получают только электролизом расплавов).
Правила, лимитирующие последовательность окисления анионов на аноде.
1. Анионы окисляются на аноде в порядке нижеприведенного ряда:
Г, S2-, В г, Cl", ОН-, F-, NO;, NO;, СО^*, SO^-, S02~ и т. д.->
- -? окисление аниона затрудняется.
- 2. Из смеси бескислородного аниона (кроме фторид-аниона) и аниона гидроксида ОН- на аноде окисляется бескислородный анион.
Из смеси анионов СГ и ОН" окисляется анион хлора.
3. Из смеси ионов гидроксида и кислородсодержащего аниона или фтррид-аниона на аноде окисляются или ионы ОН", или молекулы воды. Так, из смеси ОН" и СО^" окисляются анионы гидроксида или молекулы воды.
Следует отметить следующее:
- 1. Если электролизу подвергается соль сильного основания и сильной кислоты, то концентрация Н+ и ОН" очень мала, тогда на аноде вместо ионов ОН" окисляются молекулы воды, а на катоде восстанавливаются молекулы воды вместо катионов гидроксония (водорода).
- 2. При написании уравнений электролиза необходимо использовать суммарные уравнения восстановления (а) и окисления (б) воды, а также окисления ионов ОН" (в).
ЭЛ. ток а) 2НОН + 2е~ = H2t + 20Н" .
эл.ток б) 2Н20 — 4е~ = 02f + 4Hf
эл.ток в) 40Н~ - 4е~ = 02| + 2Н20.
Рассмотрим несколько типичных примеров химизма электролиза водных растворов солей.
1. Электролиз водного раствора хлорида меди (Н) на угольных электродах. Хлорид меди (Н) подвергается гидролизу, так как является солью слабого основания и сильной кислоты; среда раствора — кислая. Угольный электрод — инертный:

2. Электролиз водного раствора хлорида калия на угольных электродах. Угольные электроды инертны; хлорид калия — соль сильной кислоты и слабого основания, поэтому среда нейтральна:

катод (-): К+, Н+, Н20, так как концентрация Н+ очень мала, то восстанавливаются молекулы воды:
2Н0Н + 2е~ — Н2 + 20Н" (на катоде накапливаются ионы ОН", т. е. щелочь): анод (+): ОН, СГ, молекулы воды, окисляются ионы С1 :
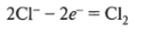
ЭЛ. ток.
(суммарно) 2КС1 + 2Н20 = 2КОН + С12Т + Н2| (возможны и вторичные процессы электролиза: так, С12 взаимодействует с КОН, образуя хлорид калия и гипохлорит калия, ит.д.).
3. Электролиз водного раствора карбоната калия на угольных электродах. Карбонат калия — соль слабой кислоты и сильного основания, подвергается гидролизу, при этом возникает щелочная реакция среды; угольные электроды — инертны:
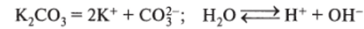
катод (-): К+, НОН, Н+ (восстанавливается преимущественно НОН, т. е. Н+ очень мало). 2НОН + 2е~ = H2t + ОН" (на катоде накапливаются ионы ОН", т. е. щелочь КОН);
анод (+): СО^", ОН", НОН (окисляются или ионы ОН", или молекулы Н20):
- а) 40Н" - 4е~ = 2Н20 + 02t
- б) 2НгО — 4е = 4Н+ + 02Т (на аноде получаются ионы Н+), поэтому возможен процесс:
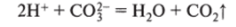
в межэлектродном пространстве возможна реакция.
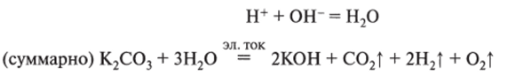
Следует отметить, что электролизу, подобно карбонату калия, будут подвергаться все растворимые карбонаты и сульфиты, т. е. сернистая и угольная кислоты при очень небольших концентрациях разлагаются на воду и газообразный ангидрид соответствующей кислоты.
4. Электролиз водного раствора хлората железа (Ш) на угольных электродах. При электролизе соли среднеактивного металла и кислородсодержащего аниона образуются металл и кислота или продукты ее разложения:
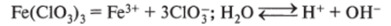
хлорат железа (Ш) — соль слабого основания и сильной кислоты, подвергается гидролизу, за счет чего возникает кислая среда, т. е. избыток Н+:
катод (-): Н+, Fe3+, Н20 (восстанавливаются ионы Fe3+): 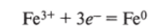
анод (+): С103, ОН, Н20 (окисляются молекулы Н20, так как ионов ОН' в растворе очень мало): 2Н20 -4е~ = 4Н+ + 02| (на аноде образуются катионы Н+); эл ток
- (суммарно) 4Fe (C103)3 + 6Н20 = 4Fe + 12НСЮ3 + 302t
- 5. Электролиз водного раствора фторида калия на угольных электродах. При электролизе фторидов, солей кислородсодержащих кислот и активных металлов происходит электролитическое разложение воды:

Это соль слабой кислоты (HF) и сильного основания (КОН) подвергается гидролизу, в результате чего возникает щелочная среда (избыток ионов ОН");
катод (-): К+, Н20 (ионов Н+ в этом растворе практически нет); восстанавливаются молекулы воды:
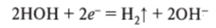
анод (+): F"; Н20, ОН; возможно окисление и молекул воды, и ионов ОН':
- а) 40Н" - 4е~ = 2Н20 + 02f
- б) 2Н20 — Ле~ = 4Н+ + 02t
Суммарно (без перемешивания):

Суммарно (при перемешивании КОН и HF реагируют друг с другом, образуя KF и воду):
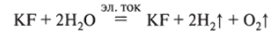
Сокращая формулу соли (KF), получим.
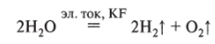
т. е. в данном случае фторид калия создает электрическую проводимость среды.
Следует отметить, что аналогично фторидам и кислородсодержащим солям щелочных металлов протекает электролиз сильных кислот и щелочей: электролизу подвергается вода, а названные соединения создают электрическую проводимость среды.
Электролиз всех рассмотренных солей (1—5) протекает на инертных электродах. В практическом отношении интересны случаи электролиза на активных электродах. Рассмотрим особенности такого электролиза солей.
6. Электролиз водного раствора хлорида железа (Н) на железных электродах. Электролиз солей на активных анодах (изготовлены или из металла, соль которого подвергается электролизу, или иного активного металла) сводится к переносу массы анода на катод:
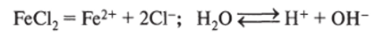
Катод (-): [Fe], Н+; Н20; Fe2+ (восстанавливаются ионы Fe2+, так как перенапряжение восстановления Н+ на железном электроде больше, чем для Fe2+):
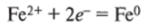
Анод (+): [Fe], ОН", СГ, Fe°, Н20; состоит из четырех видов частиц, способных окисляться на аноде, легче всего будут окисляться атомы железа:

За счет окисления железа и перехода его ионов в раствор масса анода уменьшается (анод разрушается), а масса катода увеличивается.
Суммарно: масса анода переходит на катод.
Электролиз солей на активных анодах составляет основу гальванотехники — прикладная электрохимия, включающая процессы электролитического осаждения металлов на металлические или неметаллические изделия. Гальванотехника включает в себя гальванопластику и гальваностегию.
Гальванопластика — получение точных металлических копий электролитическим осаждением металла на металлическом или неметаллическом оригинале. Применяют при создании произведений искусства.
Гальваностегия — нанесение покрытия на металлическое или неметаллическое изделие электролитическим осаждением металла. Используют как способ создания предметов искусства, а также для защиты различных изделий от коррозии.
Электролиз солей на активных анодах является эффективным методом очистки металлов от примесей, что позволяет получать металлы высокой чистоты, например получение рафинированной меди.
Электролиз широко используется в деятельности человека. На нем основаны различные электрохимические производства. Электролитически получают многие металлы и неметаллы в свободном состоянии, его применяют для образования защитных пленок на металлических изделиях (цинкование сталей), для придания изделиям высоких эстетических и художественных качеств. Электрохимические производства при нерациональной их организации могут нанести вред природной окружающей среде за счет выброса в нее сточных вод. Эти воды содержат большое количество солей тяжелых и других металлов, негативно воздействующих на природные экологические процессы. Кроме их загрязняющего воздействия, неутилизированные сточные воды наносят значительный экономический ущерб, так как в них содержатся ценные для производственной деятельности вещества.
- ? Задания для самостоятельной работы
- 1. Поясните, почему электролиз относят к окислительно-восстановительным процессам, и найдите принципиальное различие электролитических процессов от процессов, протекающих в гальванических элементах.
- 2. Назовите катион, который будет первым восстанавливаться на катоде: Zn2+, Mn2+, Fe2+; ответ обоснуйте.
- 3. Поясните, чем активные аноды отличаются от инертных; приведите примеры таких анодов.
- 4. Обоснуйте экономическую целесообразность применения электролиза расплавов.
- 5. Напишите уравнения, характеризующие электролиз водных растворов хлорида натрия, нитрита калия, хлорида цинка на угольных электродах, а также хлорида платины на платиновых электродах.