Галогениды фосфора.
Химия

Атомы остальных элементов имеют в основном состоянии конфигурацию ns? np3nd° с тремя неспаренными /7-электронами и вакантными d-АО. При изменении п меняется соотношение между энергиями разных АО, что приводит к разнообразию связей и структур даже в простых веществах, которые существуют в разных аллотропных модификациях: молекулярные структуры Э4 для фосфора, мышьяка, сурьмы; полимерные структуры… Читать ещё >
Галогениды фосфора. Химия (реферат, курсовая, диплом, контрольная)
С галогенами фосфор образует два ряда соединений — РГал3 и РГал5. Известны все четыре тригалогепида, но только три пентагалогенида. Вполне устойчивы PF5 и РС15, но нентабромид уже выше 100 °C разлагается:
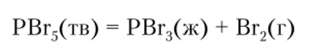
Хотя эта реакция обратима, в газовой фазе РВг5 неустойчив, а Р15 вообще не существует. Основными причинами падения устойчивости в ряду PF-—Р15 являются увеличение межъядерного расстояния Р—Гал и, как следствие этого, уменьшение энергии связи при переходе от фторидов к йодидам, а также увеличение межлигандного отталкивания при увеличении размеров галогена. Все галогениды чрезвычайно легко гидролизуются даже следами воды: 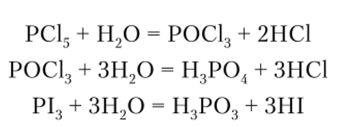
В случае пентагалогенидов промежуточными формами являются оксогалогениды, из которых РОС13 — хлорокись фосфора — находит применение как растворитель.
Общая характеристика элементов 15-й группы
Атомы азота, подобно атомам кислорода и фтора, не имеют остовных p-электронов, и азот значительно отличается по своим свойствам от других элементов группы (см. гл. 23).
Атомы остальных элементов имеют в основном состоянии конфигурацию ns?np3nd° с тремя неспаренными /7-электронами и вакантными d-АО. При изменении п меняется соотношение между энергиями разных АО, что приводит к разнообразию связей и структур даже в простых веществах, которые существуют в разных аллотропных модификациях: молекулярные структуры Э4 для фосфора, мышьяка, сурьмы; полимерные структуры с ковалентными связями красного фосфора и серого мышьяка; металлические кристаллы сурьмы и висмута.
В своих соединениях фосфор проявляет исключительно свойства неметалла, тогда как висмут — только свойства металла. Проявляется это в том, что в соединениях, устойчивых по отношению к воде, т. е. не подвергающихся быстрому и полному гидролизу, фосфор находится исключительно в анионной форме, а висмут — только в катионной. Мышьяк и сурьма могут присутствовать и в своих соединениях, и в водных растворах как в анионной, так и в катионной формах, т. е. являются амфотерными элементами.
При движении по группе сверху вниз, по мере увеличения главного квантового числа валентных электронов, растут размеры валентных АО, что приводит к ухудшению условий для их гибридизации, уменьшению электронной плотности в области перекрывания АО при образовании ковалентных связей, к увеличению их длины, а значит, и к уменьшению прочности. Эта тенденция хорошо видна на примере соединений элементов с водородом:
Соединение. | NH3 | РН3 | AsII3 | Sbil3 |
AHj 298, кДж/моль. | — 46. | +5. | +66. | +145. |
Энергия связи Э—II, кДж/моль. | ||||
Длина связи Э—Н, нм. | 0,10. | 0,14. | 0,15. | 0,17. |
Угол между связями, градусы. |
Как очевидно из этих данных, уже в соединении фосфора с водородом при образовании связи используются практически «чистые» р-АО (угол между связями Р—Н примерно 90°). Энергия связи Э—II по ряду N—Р—As—Sb быстро уменьшается, и стандартная энтальпия образования ЭН3 становится все более эндотермичной. BiH3 настолько неустойчив, что обнаруживается только в виде следов в водороде, получающемся при действии кислоты на сплав висмута с магнием, содержащий висмутид магния:
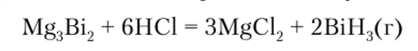
Тенденция к уменьшению устойчивости соединений ЭНг при движении по группе элементов сверху вниз характерна для всех р-элементов.
В тех случаях, когда элементы 15-й группы взаимодействуют с силыюэлектроотрицательными элементами, на центральном атоме создается некоторый эффективный положительный заряд, в результате энергия nd-АО понижается и появляется возможность их гибридизации с ns- и пр-АО. В этом случае ns- и яр-неподеленные пары могут быть разрушены, и число неспаренных электронов увеличено до пяти. Тогда центральный атом образует пять ковалентных связей, как это происходит, например, в РВгГ), AsF5, SbCl5 или высших оксидах этих элементов.
Аналогичная ситуация наблюдается в 16-й и 17-й группах. Устойчивость высших форм меняется в соответствии с вторичной периодичностью: для элементов четвертого периода она меньше. Это было видно на примере оксидов и оксокислот брома и селена. Это же хорошо видно и на примере мышьяка. Так, AsC15 в отличие от РС15 и SbCl5 неустойчив, а энтальпия образования As205 заметно меньше, чем для оксидов фосфора и сурьмы:
Соединение. | ½РА0 | As205 | sb2o5 |
&Hj 298' кДж/мОЛЬ. | — 1492. | — 926. | — 1007. |
Все высшие оксиды обладают кислотными свойствами, но в воде растворимы только Р4О10 и As4O10. Кислотно-основные свойства низших оксидов закономерно изменяются от фосфора к висмуту: Р406 — типичный ангидрид кислоты, As406 и Sb4Oe — амфотерны, тогда как Bi2Os обладает только основными свойствами и нерастворим в щелочах.
Химия висмута, как и химия всех p-элементов шестого периода, связана с особенностью строения их электронных оболочек. Как говорилось в параграфах 2.7 и 2.8, проникающая способность 5-электропов заметно больше, чем p-электронов. Связанная с этим разница в энергиях 5- и р-атомных орбиталей увеличивается по мере увеличения заряда ядра, и у р-элементов шестого периода, после появления в электронной оболочке /-электронов, эта разница уже так велика, что 5-электроны предпочитают оставаться неподеленной парой атома. В результате высшая степень окисления в соединениях p-элементов шестого периода достигается с большим трудом, такие соединения редки и, как правило, являются сильными окислителями. Само явление пониженной склонности 65-электронов к участию в образовании химических связей часто называют эффектом инертной пары.
В соответствии с «эффектом инертной пары» висмут в своих соединениях почти исключительно находится в степени окисления +3, а известные только в твердом виде висмутаты щелочных металлов — очень сильные окислители.
Многие соединения элементов 15-й группы ядовиты. Особенно это относится к соединениям мышьяка, гидридам этих элементов и их органическим производным.
Резюме
На примере трех элементов: хлор — сера — фосфор, вы можете увидеть и понять, как меняются химические свойства элементов при изменении заряда ядра и числа валентных электронов на одних и тех же валентных АО. Кроме того, рассматривая элементы 17-й, 16-й, 15-й групп, вы можете понять, как меняются их свойства при неизменном числе валентных электронов, но меняющемся характере валентных АО при движении по группе сверху вниз.
Практикум
Вопросы для самоконтроля
- 1. Почему реакционная способность белого фосфора гораздо больше, чем красного?
- 2. На чем основано применение пентаоксида фосфора для осушки газов?
- 3. Оксид мышьяка (Ш) растворили: а) в воде; б) в растворе щелочи; в) в концентрированной соляной кислоте. Что получится в растворе в каждом из этих случаев?
Аналитические задания
- 1. Хотя фосфин и неустойчив, при растворении тригалогенидов фосфора в воде всегда чувствуется запах фосфина. Объясните, откуда он появляется.
- 2. Высший хлорид фосфора может отдавать хлор, переходя либо в трихлорид, либо в оксохлорид. Рассмотрите его реакции: а) с железом; б) с оксидом желсза (Ш).
Задачи для самостоятельного решения
- 1. В чем состоит существенное различие в электронном строении молекул Р2 И Р4?
- 2. Пентагалогениды фосфора проще всего получать прямым синтезом из элементов, а тригалогениды — косвенным путем, восстановлением пентагалогенидов. Объясните, почему чистый трихлорид проще получить из РС1Г), чем прямым синтезом. Чем следует восстанавливать РС15?
- 3. При добавлении даже очень небольших количеств As203 в реагирующую систему Zn + НС1 вместе с водородом немедленно начинает выделяться арсин. Составьте уравнение реакции его образования.