Структура электронных конфигураций атомов

Главное квантовое число п задает номер уровня и, соответственно, число подуровней, которое может быть большим, например равным 1000. Но для невозбужденных атомов оно не превышает число 7. Главное число характеризует энергию уровня и средний радиус атомных орбиталей. Чем выше п, тем энергия электрона больше, а электронная оболочка расположена дальше от ядра атома. Читателю нетрудно убедиться… Читать ещё >
Структура электронных конфигураций атомов (реферат, курсовая, диплом, контрольная)
Состояние электрона в атоме задается не только главным квантовым числом п, рассмотренным в предыдущем параграфе, но еще тремя квантовыми числами, а именно /, Ш/ и ms. Дело в том, что важнейшими характеристиками электрона являются орбитальный момент (Mj), орбитальный магнитный момент (М/>) и спиновый момент (MS2). И все три пропорциональны постоянной Планка (Й): 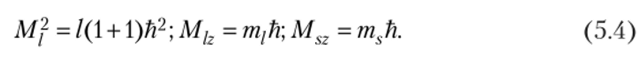
Коэффициенты пропорциональности п, /, тп/ и ms называются квантовыми числами. Разумеется, всегда следует учитывать, что они стоят при соответствующих параметрах. Орбитальный момент указывает на подвижный характер электронной орбитали. Электрон не есть всего лишь неподвижная точка. Орбитальный магнитный момент указывает на еще одно обстоятельство: в качестве подвижной относительно ядра атома частицы, обладающей отрицательным зарядом, электрон является магнитом. Но электрон обладает также и собственным магнитным моментом (спином), наличие которого подтверждено экспериментально. Его природа пока никак не объясняется.
Что касается возможных значений квантовых чисел, то они представлены в табл. 5.2.
Квантовые числа.
Таблица 5.2
Название. | Символ. | Возможные значения. | Примеры значений. |
Главное число. | N | 1 >п | я =1,2, 3,… |
Азимутальное число. | 0 </< и -1. | Для п = 4: / = 0, 1,2 (s, р, d) | |
Магнитное (азимутальное) число. | mi | -/ < ml < 1 | Для/=2: W/=-2, -1,0, 1,2. |
Спиновое число. | ms | — ½,-И/2. | + ½. |
Главное квантовое число п задает номер уровня и, соответственно, число подуровней, которое может быть большим, например равным 1000. Но для невозбужденных атомов оно не превышает число 7. Главное число характеризует энергию уровня и средний радиус атомных орбиталей. Чем выше п, тем энергия электрона больше, а электронная оболочка расположена дальше от ядра атома.
Азимутальное число / характеризует энергию подуровня, которая зависит от орбитального момента. Оно также характеризует тип подуровня, который, по историческим основаниям, задается маленькими латинскими буквами s (l = 0), р (1 =1), d (l = 2),/(/ = 3), g (l = 4) и т. д.
В теории показывается, что для любого / имеется 21 + 1 атомных орбиталей, которые все обладают одинаковой энергией и переходят в друг друга при соответствующих поворотах. Если / = 0, то 2/ + 1 = 1. Это означает, что при поворотах форма атомной орбитали не изменяется. Этому условию соответствует форма сферы. Следовательно, форма 5-атомной орбитали является сферической. Если / = 1, то 2/ + 1 = 3. Три формы р-атомной орбитали таковы, что они переходят друг в друга, причем ведут себя так же, как координаты х, г/, 2. Этому условию соответствует двухлепестковая форма. Если / = 2, то 2/ + 1 = 5. Поэтому ^/-атомные орбитали имеют 5 форм. Все описанные нами формы представлены на рис. 5.3 (не беда, если читателю непонятны некоторые математические члены, используемые для описания орбиталей. Важно усвоить главное — что атомные орбитали, соответствующие определенному значению /, обладают некоторыми группами симметрии).
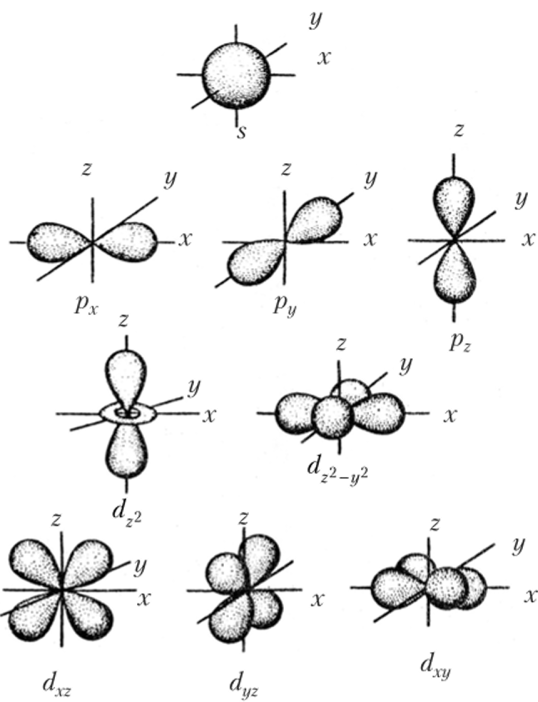
Рис. 5.3. Формы s-, p-у {/-атомных орбиталей1.
Магнитное число характеризует число атомных орбиталей и их ориентацию в магнитном поле атома. Спиновое число характеризует непосредственно индивидуальность электрона. Его часто изображают в форме маленьких вертикальных стрелочек. Направление отдельно взятого спина может быть любым, но если оно выбрано, то направление антагонистического спина будет противоположным. После всего сказанного становится понятной структура электронных уровней. Она представлена в табл. 5.3.
Таблица 5.3
Структура электронных уровней
Главное квантовое число п | |||||||||||||||
Максимальное число электронов на энергетическом уровне: Х" = 2 п2 | |||||||||||||||
Орбитальное число / | |||||||||||||||
Символ подуровня. | 2р | 3Р | 3d | 4р | 4с1 | 4/. | 5s | 5р | 5d | 5/. | 5g | ||||
Максимальное число электронов на подуровне: Х/= 2 (2/ + 1). | |||||||||||||||
1 URL: http://www.vzf.mstu.edu.ru/materials/method17/02/wpe5.gif/.
Читателю нетрудно убедиться в правильности формул X/ = 2(2/ + 1) и Хп = 2 т?2. Первая из этих формул правильна постольку, поскольку при данном / магнитное квантовое число принимает 21 + 1 значений. Но к тому же следует учитывать, что каждому этому значению соответствует два спина. В результате получается формула X/ = 2(2/ +1). Сумма всех X/, относящихся к данному я, дает п2.
Выводы.
- • Орбитальный момент (Mj), орбитальный магнитный момент (M/z) и спиновый момент (Msz) кратны постоянной Планка (Pi).
- • Атомные орбитали, соответствующие определенному значению /, обладают некоторыми группами симметрии.
- • Максимальное число электронов, относящихся к одному и тому же энергетическому уровню или подуровню, является вполне определенным, а не произвольным.