Реакции катиона натрия

Потирание стеклянной палочкой необходимо, чтобы предотвратить образование пересыщенного раствора Na и ускорить выпадение осадка. Прежде чем делать вывод об отсутствии иона Na+, нужно дать содержимому пробирки постоять 10—15 мин. Кислоты же, как отмечалось выше, разлагают K с выделением осадка метасурьмяной кислоты. Ионы Mg2+ образуют с реактивом белый кристаллический осадок гексагидроксостибиата… Читать ещё >
Реакции катиона натрия (реферат, курсовая, диплом, контрольная)
Гексагидроксостибиат (У) калия K[Sb (OH)6]. Этот реактив осаждает из растворов солей натрия белый кристаллический осадок гексагидроксостибиата (У) натрия:
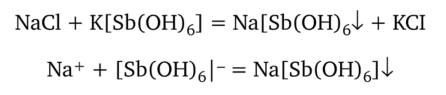
К 2—3 каплям раствора соли натрия необходимо прибавить равный объем реактива, охладить под краном с холодной водой и потереть стеклянной палочкой внутреннюю поверхность стенок пробирки; при этом появляется белый мелкокристаллический осадок. Для безошибочного обнаружения иона Na+ необходимо соблюдать следующие условия. Реакцию можно выполнять только в нейтральной среде раствора (pH 7), так как в кислой среде гексагидроксостибиат (У) калия превращается в ортосурьмяную кислоту H3Sb04:
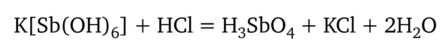
которая разлагается с выделением аморфного осадка метасурьмяной кислоты HSb03:
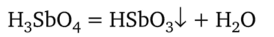
Поэтому, наблюдая выпадение аморфного осадка в кислой среде, нельзя делать вывод о присутствии ионов Na+. В сильнощелочной среде осадок Na[Sb (OH)6] растворяется с образованием средней соли Na3Sb04:
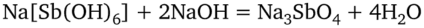
По этим причинам кислый анализируемый раствор предварительно нейтрализуют КОН (можно и К2С03), а щелочной — слабой кислотой (обычно — уксусной). Поскольку растворимость Na[Sb (OH)6] при нагревании сильно возрастает, то осаждение выполняют на холоде (15—20 °С).
Потирание стеклянной палочкой необходимо, чтобы предотвратить образование пересыщенного раствора Na[Sb (OH)6] и ускорить выпадение осадка. Прежде чем делать вывод об отсутствии иона Na+, нужно дать содержимому пробирки постоять 10—15 мин.
Обнаружению иона Na+ с помощью K[Sb (OH)6] мешают ионы NH} и Mg2+. Соли аммония, образованные сильными кислотами, создают в растворе кислую среду вследствие гидролиза:
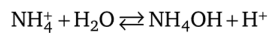
Кислоты же, как отмечалось выше, разлагают K[Sb (OH)6] с выделением осадка метасурьмяной кислоты. Ионы Mg2+ образуют с реактивом белый кристаллический осадок гексагидроксостибиата (У) магния, который можно ошибочно принять за Na[Sb (OH)6]:
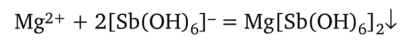
Мешают обнаружению Na+ и катионы второй аналитической группы. Следовательно, катион Na+ можно обнаруживать действием K[Sb (OH)6] только после того, как из раствора удалены ионы NH}, Mg2+, а также катионы второй группы. Эта реакция не отличается высокой чувствительностью (предельное разбавление 3,3 • 103 мл/г) и позволяет обнаруживать ионы Na+ в достаточно концентрированных растворах. Слишком разбавленные растворы концентрируют выпариванием. Обнаруживаемый минимум — 800 мкг. Чувствительность повышается при выполнении реакции микрокристаллоскопически. Микрокристаллоскопическая реакция: на предметное стекло помещают каплю нейтрального исследуемого раствора, прибавляют каплю гексагидроксостибиата калия и осторожно выпаривают досуха. В присутствии натрия образуются кристаллы, имеющие форму линз или призм. Обнаруживаемый минимум — 0,3 мкг.
Ацетат цинк-уранила Zn (CH3C00)2-3U02(CH3C00)2. Из растворов солей натрия, подкисленных уксусной кислотой, этот реактив осаждает зеленовато-желтые тетраэдры ацетата натрий-цинк-уранила:
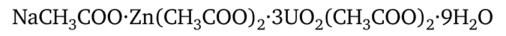
На предметное стекло нужно внести каплю раствора соли натрия и выпарить досуха. Затем поместить рядом каплю реактива и концом палочки соединить ее с сухим остатком. Через 2—3 мин выпавшие кристаллы рассматривают под микроскопом.
Реакция очень чувствительна (обнаруживаемый минимум — 0,01 мкг Na+). Другие катионы первой и второй аналитических групп не мешают обнаружению, если их количество не превышает концентрацию Na+ в десятки раз.
Проба на окрашивание пламени. Все летучие соли натрия окрашивают бесцветное пламя горелки в интенсивно-желтый цвет. Для выполнения пробы лучше всего взять хлорид натрия как наиболее летучее соединение.
Стеклянную палочку с впаянной в нее платиновой проволочкой вносят в пламя. Если проволочка достаточно чиста, пламя останется бесцветным. В противном случае ее надо очистить, опуская в хлороводородную кислоту и снова внося в пламя до тех пор, пока оно не перестанет окрашиваться. Очищенную проволочку погружают в раствор хлорида натрия или захватывают петлей немного сухой соли и вносят в бесцветное пламя. Пламя окрасится в характерный для натрия желтый цвет.