Механизм бактериального окисления

При переносе электронов по цитохромной цепи от железа на кислород создается протонный потенциал и выделяется достаточное количество энергии, чтобы синтезировать одну молекулу АТФ на два прошедших электрона. Для этого необходимо чтобы величина Еh была равна 0,33 В. На внутренней стороне мембраны, где происходит восстановление кислорода, потенциал пары 0,5 O2/H2O при рН 5−6 равен 0,89 В, в то время… Читать ещё >
Механизм бактериального окисления (реферат, курсовая, диплом, контрольная)
Механизм бактериального окисления и выщелачивания сульфидных минералов можно представить на примере арсенопирита следующим образом с учетом кинетики процесса и особенностей биохимического окисления железа и серы.
Бактериальные клетки сорбируются и прочно закрепляются на поверхности арсенопирита. Под действием химических агентов кислорода и трехвалентного железа, а также биологических агентов ферментативных систем бактерий элементы кристаллической решетки минерала — железо и сера — подвергаются окислению, при этом поверхность минерала разрушается и компоненты кристаллической решетки выщелачивается. Двухвалентное железо, образующееся при этом, входит в состав активного центра фермента, как связующее звено между минералом и ферментом, находясь с обоими в соединении и удерживая субстрат около активного центра фермента. Последующий распад этого комплекса дает конечный продукт окисления — трехвалентное железо. Подобному бактериальному окислению подвергается сульфидная сера, конечным продуктом ферментативного окисления которой является сульфат-ион.
В соответствии с реакцией:
FeAsS > Fe2++ As3+ + S0 + 7e.
при электрохимическом процессе на поверхности арсенопирита образуется закисное железо, элементная сера и мышьяковистая кислота:
FeAsS + Fe2(SO4)3 +1,5 H2O + 0,75 O2 = 3 FeSO4 + S0 + 7e.
На поверхности арсенопирита железо и сера подвергаются биокаталитическому окислению до соединений высшей степени окисления. Элементная сера под действием серусодержащих ферментов переходит в ?-модификацию и окисляется до сульфат — ионов.
S0 + 4 H2O > SO42- + 8 H+ + 6з или S0 + H2O + 1,5 O2 = H2SO4 (9).
Двухвалентное железо, которое образуется при деструкции кристаллической решетки минерала за счет восстановления трехвалентного железа арсенопирита с принятием электронов от серы и мышьяка, окисляется микроорганизмами до трехвалентного в диффузионном слое минерала и при выходе его из минерала в объеме раствора:
2 FeSO4 + 0,5 O2 + H2SO4 > Fe2(SO4)3 + H2O. (10).
Окисное железо при этом частично переходит в раствор и остается в диффузионном слое минерала, что обеспечивает его быстрое взаимодействие с сульфидной поверхностью.
Мышьяк в растворе присутствует в виде мышьяковистой кислоты, т.к. он может существовать в виде катиона только в сильнокислых растворах:
As3+ + 3 H2O = AsO33- + 6 H+ = H3AsO3 + 3 H+
Мышьяковистая кислота, в свою очередь, окисляется до мышьяковой кислородом:
H3AsO3 + 0,5 O2 > H3AsO4.
При наличии в растворе окисного железа образуется арсенат:
Fe3+ + H2AsO4- > FeAsO4 + 2 H+.
Таким образом, конечными продуктами бактериального окисления и выщелачивания арсенопирита являются арсенат железа и серная кислота:
FeAsS + 3,5 O2 + H2O > FeAsO4 + H2SO4. (11).
Схематическая модель механизма бактериального окисления арсенопирита представлена на рис. 1, где показана тесная связь процессов биологического характера и связанных с ними электрохимических процессов на поверхности арсенопирита и в объеме жидкой фазы. Поэтому ускорение ферментативными системами бактерий электрохимических реакций окисления сульфидных минералов можно назвать биоэлектрокатализом.
Подобный механизм бактериального окисления и выщелачивания сульфидных минералов характерен и для других минералов, как содержащих в своей структуре железо, так и не имеющих его.
Общими при бактериальном окислении сульфидных минера-лов, содержащих железо, будут реакции 4 и 5, остальные реакции окисления.
- — для пирита:
- 2 FeS2 + 7 O2 + 2 H2O >2 Fe2+ + 4 SO2-4 + 4 H;+
FeS2 + 14 Fe3++ 8 H2O >15 Fe2++ 2 SO42-+ 16 H;+
для халькопирита:
2 CuFeS2+ 8,5 O2+ 2 H+ > Cu2++ 2 Fe3++ 4 SO42++ H2O;
CuFeS2 + 4 Fe3+ > Cu2++ 5 Fe2++ 2 S0;
для пирротина:
- 2 FeS + 4,5 O2+ 2 H+ >2 Fe3++ 2 SO42-+ H2O;
- 2 FeS + 1,5 O2+ 6 H+ >2 Fe3++ 2 S0 + 3H2O;
FeS + 8 Fe3++ 4 H2O > 9 Fe2++ SO42-+ 8 H+;
— для сульфидов, не содержащих железа, например, сфалерита:
ZnS + 2,5 O2 + 2 H+ >Zn2++ SO42-+ H2O; (12).
ZnS = Zn2-+ S0 + 2з;
Однако в рассматриваемом механизме не учитывается один немаловажный фактор — наличие в выщелачиваемом материале нескольких сульфидных минералов, которые отличаются своими электрохимическими характеристиками, а, следовательно, находясь в пульпе в присутствии бактерий, оказывают взаимное влияние на окисление и выщелачивание друг друга.
Рассмотрим механизм электрохимических реакций при бактериальном выщелачивании смеси минералов — арсенопирита и пирита.
Катодная реакция гальванического взаимодействия арсенопирита и пирита (ц=0,45 В) может осуществляться тремя различными путями:
— деполяризация пирита кислородом.
O2 + 4 H+ + 4e > 2 H2O; (13).
деполяризация пирита окисным железом.
Fe3+ + e > Fe2+ ;
Смешанная деполяризация кислородом и окисным железом.
O2 +Fe3+ + 4 H+ + 5e >Fe2+ + 2 H2O. (14).
Эти катодные реакции дополняются анодной.
FeAsS + 3 H2O > Fe2+ + AsO33- + 6 H+ + S0 +5e; (15).
Сумма реакций (13) и (15).
4 FeAsS + 2 H2O +5 O2 +4 H2SO4 > 4 FeSO4 + 4 H3AsO3 + 4 S0
представляет собой механизм окисления арсенопирита при непосредственном взаимодействии его с бактериями и кислородом, т. е. «прямой» механизм.
Сумма реакций (14) и (15).
2 FeAsS+2O2+Fe2(SO4)3+H2SO4+2H2O > 4FeSO4+2S0+2H3AsO3
представляет собой механизм окисления арсенопирита оксидным железом при участии бактерий, т. е. «косвенный» механизм.
При деполяризации пирита в условиях бактериального выщелачивания основным деполяризатором является оксидное железо. Скорость реакции, проходящей при участии кислорода в 500−600 раз меньше скорости, обусловленной наличием оксидного железа, которого в 20−25 тысяч раз больше концентрации кислорода. Поэтому по катодной (12) и анодной (13) реакциям основная роль при окислении арсенопирита принадлежит Fe3+.
2FeAsS+5Fe2(SO4)3+6H2O >12FeSO4+2S0+2H3AsO3+3H2SO4 (16).
Помимо реакции (8) протекают реакции:
- 4 FeSO4 + O2 + 2 H2SO4 > 2 Fe2(SO4)3 + 2 H2O
- 2 S0 + 3 O2 +2 H2O > 2 H2SO4
- 3 H3AsO3 + 2 Fe2(SO4)3 + 2 H2O > 4 FeSO4 + 2 H2SO4 + 2 H3AsO4
Fe2(SO4)3 + H3AsO4 > 2 FeAsO4 v + 3 H2SO4
итоговая реакция.
2 FeAsS + 7 O2 + 2 H2O > 2 FeAsO4 + 2 H2SO4
Схема механизма бактериального окисления арсенопирита в присутствии пирита и микроорганизмов представлена на рис. 2.
- а)
- б)
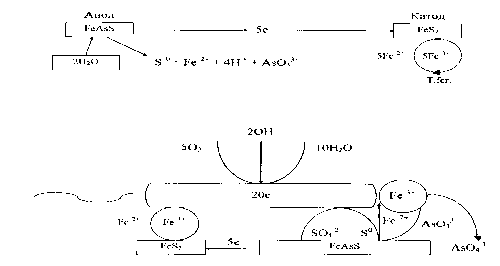
Рис. 2. Схема механизма бактериального окисления пирита и арсенопирита, представленного в виде катодно-анодной реакции (а) и в присутствии клетки (б)
При рН 2,0−1,2, ОВП жидкой фазы 0,78−0,84 В и концентрации железа 7…15 г/л, арсенопирит термодинамический неустойчив и деструктирует через промежуточные фазы реальгара и аурипигмента с образованием закисного железа, о-мышьяковистой кислоты и элементной серы. Арсенопирит заряжается отрицательно, координируя вокруг себя положительно заряженную сферу.
Пирит является первичным акцептором электронов. Ионы оксидного железа (0,5−1 моль/л) восстанавливаются на пирите до закисного, который выполняет функцию вторичного акцептора электронов. При этом анодная и катодная реакции делокализованы в пространстве. Образующееся закисное железо окисляется бактериями до окисного. Конечным акцептором электронов является кислород. Окисление закисного железа осуществляется бактериями, как находящимися в растворе, так и иммобилизованными на минерале. Окисление элементной серы бактериями происходит в основном на поверхности минерала. Таким образом, бактерии катализируют процессы окисления элементов кристаллической решетки (Fe2+ и S2-), т. е. служат переносчиками электронов к их конечному акцептору кислороду через цепь промежуточных акцепторов — пирит и оксидное железо.
Известно, что в обычных условиях многие окислительно-восстановительные реакции, которые используются микроорганизмами в качестве энергетического источника, протекают крайне медленно. К этим реакциям относится реакция окисления закисного железа до окисного. Железо (II) при рН менее 3 почти не окисляется, но в присутствии бактерий скорость окисления увеличивается почти в 200 тысяч раз.
При окислении железа кислород выступает в роли акцептора, реакцию его окисления можно представить в виде.
Fe2+ = Fe3+ + e; (17).
O2 + 4H+ + 4e = 2H2O; (18).
4Fe2++4H++O 2= 4Fe3++2H2O (19).
Энергия Гиббса последней реакции равна G = - 38,3 ккал, а потенциал.
Е= 0,771+0,09 lg (Fe3+ / Fe2-) (20).
Энергетический метаболизм, т. е. реакции, сопровождающиеся мобилизацией энергии и запасами ее в форме АТФ, используемой клетками А. ferrooxidans при биосинтезе, заключается в превращении химической реакции восстановленных химических соединений в биологически доступную энергию макроэргических связей. Донорами электронов в этом энергетическом процессе является неорганическое вещество, в частности закисное железо, акцептором — молекулярный кислород.
С учетом имеющихся экспериментальных данных по ферментативной кинетике биохимическое или биокаталитическое окисление железа можно объяснить с используя основные положений хемоосмотической гипотезы Ингледью. Первичным акцептором электронов при окислении железа (II) является медьсодержащий белок-рустицианин, который стабилен при рН 2 и способен взаимодействовать с железом. Этот белок восстанавливается на внешней стороне мембраны, где находятся цитохромы С (рис.3).
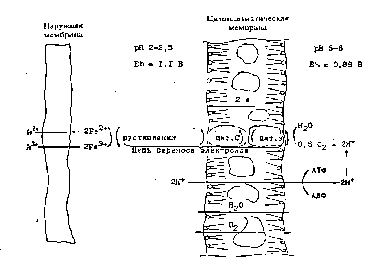
Рис. 3. Хемиоосмотическиий механизм биохимического окисления Fe2+, бактериями А. ferrooxidans
Далее электрон переносится по цитохромной цепи на кислород. Восстановление кислорода осуществляется уже на внутренней стороне цитоплазматической мембраны. Таким образом, реакция окисления железа (II) происходит на внешней стороне мембраны, причем Fe2+, Н+ и О2 поступают из внешней фазы, а продукты окисления Fe3+ и Н2О возвращаются в нее. Причем Fe3+ возвращается в раствор в виде хелатных соединений с ферментами, часть его разрушается, а около 50% постоянно присутствует в растворе в виде отрицательно заряженного комплекса.
При переносе электронов по цитохромной цепи от железа на кислород создается протонный потенциал и выделяется достаточное количество энергии, чтобы синтезировать одну молекулу АТФ на два прошедших электрона. Для этого необходимо чтобы величина Еh была равна 0,33 В. На внутренней стороне мембраны, где происходит восстановление кислорода, потенциал пары 0,5 O2/H2O при рН 5−6 равен 0,89 В, в то время как на внешней стороне мембраны при рН 2 этот потенциал составляет 0,22 В. Эта разница образуется в основном за счет градиента рН и только 0,12 В поступает от дыхательной цепи клетки.
Таким образом, основная часть энергии при окислении Fe2+ бактериями генерируется при передаче ионов Н+ в результате хемоосмотической АТФ — фазной реакции, протекание которой обеспечивается градиентом рН и мембранным или протонным потенциалом. Потребление протона на внутренней стороне цитоплазматической мембраны при окислении железа приводит к подщелачиванию среды внутри клетки до рН 5,5−6 по реакции.
2Fe2+ + 0,5O2+2H+ = 2Fe3+ +H2O.
Окисление железа (II) происходит на внешней стороне цитоплазматической мембраны, когда электроны посредством цитохромной системы проходят через мембрану и поступают в клетку, где кислород, принимая электроны, окисляется до воды, и получаемая при этом энергия идет для синтеза АТФ, используемой бактериями для фиксации углекислоты в процессе хемосинтеза и роста клеток.
Сера, как известно, входит в состав сульфидных минералов в виде S2-. При бактериальном окислении сульфидов окисление сульфидной серы до элементной происходит при электрохимической реакции окисления сульфидной поверхности и под действием бактерий, например:
FeS2 + Fe2(SO4)3 = 3FeSO4+2S.
при участии ферментов — сульфидооксидазы и полисульфидооксидазы. Окисление этой серы бактериями сопряжено также с генерацией АТФ.
Образующаяся элементная сера является единственным твердым продуктом окисления таких сульфидных минералов, как арсенопирит, пирит, пирротин, халькопирит и др. Элементная сера переходит в пульпу при выщелачивании в виде отдельных агрегатов, а также покрывает поверхность минералов. На этой сере происходит адгезия минеральных клеток, которые при таком непосредственном контакте осуществляют ее окисление до сульфат — ионов. Следует учитывать, что при бактериальном окислении таких хорошо окисляющихся минералов, как пирротин, образуется большое количество элементной серы, которая является хорошим субстратом для бактерий А. thiooxidans. Поэтому в жидкой фазе пульпы количество этих бактерий увеличивается до 109-1010 кл/мл.
Общая схема бактериального окисления сульфидной серы может быть представлена в виде:
S2- > Sов > SO32-> SO42- (21).
Ромбическая элементная сера перед окислением ее ферментами должна быть в таком состоянии, при котором возможно ее растворение липидами и фосфолипидами микробного синтеза. Поэтому при бактериальном окислении сульфидной серы образуется элементная сера в-модификации, которая хорошо растворяется в таких органических растворителях как липиды и фосфолипиды. Сера в-модификации, растворенная компонентами мембраны клеток, транспортируется в периплазматическое пространство клетки, где окисляется на наружной стороне цитоплазматической мембраны и на ее инвагинатах при участии ферментов.