Химические свойства алканов

Обрыв цепи при жидкофазном окислении. Гибель свободных радикалов может происходить при взаимодействии их со стенкой реактора. Вследствие высокой вязкости среды в жидкой фазе диффузия радикалов к стенке затруднена и в ней происходит в основном квадратичный обрыв цепи: Муравьиная кислота В промышленной практике окисление алканов ведут в газовой фазе при значительном избытке углеводородов без… Читать ещё >
Химические свойства алканов (реферат, курсовая, диплом, контрольная)
Алканы достаточно инертны ко многим реагентам.
Полное окисление. Полное окисление при избытке кислорода протекает по схеме реакции горения:
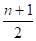
СnH2n + 2 + [n + ] nCO2 + (n + 1) H2O. (4.1).
4.5.2. Неполное окисление, согласно теории Н. Н. Семенова и Н. М. Эммануэля, протекает по радикально-цепному механизму и включает четыре стадии: зарождение цепи, продолжение цепи, разветвление цепи и обрыв цепи.
Зарождение цепи
RH + O2 R + HO2; (4.2).
2RH + O2 2R + H2O2. (4.3).
Энергия разрыва связи С — Н в зависимости от природы соединения составляет от 290 до 420 кДж/моль.
Продолжение цепи
R + O2 RO2; (4.4).
RO2+ RH ROOH + R. (4.5).
гидропероксид Возможна и такая реакция, особенно при жидкофазном окислении, протекающая с разрывом связи С — С:
RO2 R/CHO + R//O. (4.6).
Разветвление цепи
ROOH RO + OH (4.7).
или.
ROOH + RH RO + R + Н2О; (4.8).
2RO ROOR. (4.9).
пероксид.
Обрыв цепи при жидкофазном окислении. Гибель свободных радикалов может происходить при взаимодействии их со стенкой реактора. Вследствие высокой вязкости среды в жидкой фазе диффузия радикалов к стенке затруднена и в ней происходит в основном квадратичный обрыв цепи:
R + R R — R; (4.10).
R + RO R — O — R; (4.11).
R + RO2 2ROH; (4.12).
2R + H2O2 2ROH и т. д. (4.13).
Эти реакции идут с небольшой энергией активации (4 — 8 кДж/моль).
Неполное окисление легких углеводородов. Известны в промышленности процессы окисления метана, этана, бутана. Окисление легких алканов ведут при низких (150 — 250 оС) и высоких (400 — 600 оС и выше) температурах с применением катализаторов и без них при различных временах контакта.
В зависимости от условий реакции протекают по-разному.
электрический пиролиз.
2СН4 С2Н2 + 3Н2; (4.14).
СН4 + ½О2 СО + 2Н2; (4.15).
синтез-газ.
Мn2+ или Cu2+
СН4 + ½О2 СН3ОН + 130 кДж/моль; (4.16).
метанол катализатор СН3ОН + ½О2 НСНО + Н2О + 147 кДж/моль; (4.17).
Формальдегид.
Pt (Pd)
НСНО + ½О2 НСООН + 275 кДж/моль. (4.18).
Муравьиная кислота В промышленной практике окисление алканов ведут в газовой фазе при значительном избытке углеводородов без катализатора при температуре 330 — 370 оС. О влиянии соотношения углеводород: кислород на примере пропилена дает представление табл. 4.5.
Таблица 4.5.
Химический состав продуктов окисления С3Н6 при 275 оС.
Продукт. | Объемное соотношение С3Н6: воздух. | ||||
1:20. | 1:15. | 1:3,6. | 1:1,25. | 1:0,15. | |
Альдегиды. | 12,5. | 6,6. | 12,0. | 16,1. | 16,7. |
Спирты. | 17,3. | 25,7. | 23,0. | 33,1. | 34,5. |
Изопропанол. | 2,7. | 6,9. | 5,2. | 5,2. | 14,4. |
Ацетон. | 1,2. | 1,4. | 1,3. | 7,4. | |
Кислоты. | 13,9. | 13,4. | 15,2. | 8,9. | 12,5. |
Всего продуктов неполного окисления. | 47,3. | 56,0. | 56,7. | 63,6. | 85,5. |
Диоксид углерода. | 31,5. | 25,0. | 22,1. | 10,5. | 6,5. |
Монооксид углерода. | 20,9. | 19,0. | 21,2. | 25,9. | 8,0. |
Как следует из табл. 4.5, снижение доли воздуха в смеси углеводород — воздух приводит к увеличению выхода кислородсодержащих органических соединений и соответственно снижению выхода оксидов углерода.
Высшие алканы (С10 и выше) окисляют в соответствующие спирты, из которых затем получают алкилсульфаты, необходимые для производства синтетических моющих средств (СМС). При этом в качестве катализатора применяют ортоборную кислоту (Н3ВО3).
Твердые алканы окисляют в карбоновые кислоты при использовании в качестве катализатора смеси стеаратов Мп+2, Со+2, Fe+3 и К+ или Nа+. При температуре 100−130 оС. Полученные при этом синтетические жирные кислоты (СЖК) применяют для получения мыла, пластических смазок, пластификаторов, эмульгаторов, стабилизаторов и ингибиторов коррозии.