Кинетика химических реакций

Сумма показателей степеней («д + «в + …) в кинетическом уравнении называется общим порядком реакции, а показатель степени при концентрации вещества называют порядком реакции по i-му веществу. Порядки реакций могут быть целыми, дробными и нулевыми. Наиболее часто встречаются реакции первого, второго и иногда — третьего порядков. Некоторые реакции имеют дробный порядок, например 0,5 и 1,5. Реакции… Читать ещё >
Кинетика химических реакций (реферат, курсовая, диплом, контрольная)
Освоение изложенного материала позволит:
знать определения и вычисления скоростей химических реакций, закон действующих масс, способ определения порядка реакций, выражение константы скорости реакции в гомогенных и гетерогенных системах; знать: почему не существует четырехмолекулярных реакций; как связана скорость многостадийного химического процесса со скоростями отдельных стадий; может ли скорость реакции быть постоянной в течение всего процесса; в чем отличие понятия скорости реакции для гомогенных и гетерогенных систем; каков физический смысл константы скорости реакции и от каких факторов она зависит; как величина энергии активации влияет па скорость реакции при повышении температуры; как изменяется энергия активации в присутствии катализатора;
уметь рассчитывать скорость реакций в зависимости от концентрации реагентов, величины давления (в газовых средах) при изменении давления и температуры процесса, применяя температурный коэффициент (у-гамма) по Вант-Гоффу (2—4). Иметь понятие о диффузионных процессах и кинетических, протекающих в специальных реакторах;
владеть практическими приемами увеличения скоростей реакций в присутствии и без катализаторов в гомогенных и гетерогенных условиях с учетом того, что до 90% практически важных процессов являются каталитическими.
Если термодинамика отвечает на вопрос, возможно ли протекание данной реакции самопроизвольно или для ее проведения необходима затрата энергии, то химическая кинетика раскрывает закономерности протекания реакций во времени. Одни реакции идут быстро (реакции нейтрализации), иногда в виде взрыва (реакция водорода с кислородом). Другие проходят за минуты или часы (растворение металлов в кислотах). Некоторые реакции длятся месяцами и даже годами (коррозия металлов, ферментация вина).
Узнать, как быстро идет реакция, можно только из эксперимента. Знание, как на скорость химического процесса влияют различные факторы, позволяет управлять течением химического превращения в целом.
Скорость химической реакции равна изменению концентрации вещества в единицу времени в единице реакционного пространства.
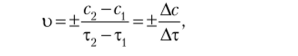
где с, и с2~ концентрации вещества в моменты времени т, и т2 соответственно (знак (+), если скорость определяется по продукту реакции, знак (-) — по исходному веществу).
Мгновенная (истинная) скорость реакции при Дт —> О или скорость реакции в данный момент времени равна.
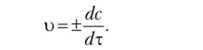
Для гетерогенных реакций скорость зависит от площади поверхности раздела фаз. Поэтому изменение концентрации вещества относят к единице поверхности вещества более плотной фазы:
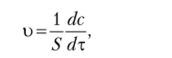
где S — площадь поверхности.
Скорость реакции в системе СИ имеет единицу измерения моль/м3 • с, однако используются также и другие единицы измерения: моль/л • с, моль/см3 • с, моль/см3? мин.
Реакции протекают при столкновении молекул реагирующих веществ. Их скорость определяется количеством столкновений и вероятностью того, что они приведут к превращению. Число столкновений определяется концентрациями реагирующих веществ, а вероятность реакции — энергией сталкивающихся молекул.
Факторы, влияющие на скорость химических реакций Природа реагирующих веществ
Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекуле Н2 требуется энергия 435 кДж/моль; такие молекулы требуют значительной энергии для диссоциации ковалентной связи. Для разрыва связей в сильнополярных молекулах — НС1, Н20 (см. гл. 3) — требуется меньше энергии, а скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно.
Пример 6.1. Реакция водорода (Н2) со фтором (F2) при комнатной температуре протекает мгновенно и со взрывом: Н2 + F2 = 2HF, с бромом (Вг2) — медленно даже при нагревании: [ + Вг.; = 2НВг, с кислородом (02) — при комнатной температуре реакция не протекает, а при 700 °C проходит быстро и со взрывом: 2Н2+ 02 = 2Н20.
Оксид кальция (СаО) вступает в реакцию с водой энергично, с выделением теплоты (СаО(|^ + Н20(ж) = Са (ОП)2(к>); оксид меди (СиО) — не реагирует с водой.
Концентрация
С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ — скорость реакции возрастает. Эта зависимость описывается основным кинетическим уравнением, приведенным ниже.
Скорость гомогенной химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ.
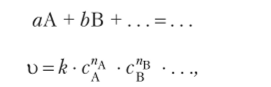
где k — константа скорости прямой реакции; сА, св и т. д. — концентрации исходных веществ А, В и т. д.; пА, «в и т. д. — коэффициенты, называемые порядками реакции по веществам А, В и т. д.
Это кинетическое уравнение является выражением закона действующих масс для химической кинетики, сформулированного К. Гульдбергом и П. Вааге в 1867 г. и независимо от них русским ученым Н. Н. Бекетовым в 1875 г. Следует подчеркнуть, что этот закон строго выполняется только для гомогенных реакций, протекающих в разбавленных растворах, или при взаимодействии газов, близких, но свойствам к идеальным, т. е. находящихся при низком давлении.
Физический смысл константы скорости химической реакции (k) заключается в том, что она численно равна скорости реакции (и = к) при концентрациях реагирующих веществ 1 моль/л. Константа скорости реакции зависит от природы реагирующих веществ, температуры и катализатора (вещества, ускоряющего протекание реакции), но не зависит от концентраций реагентов. Ее вычисляют из опытных данных при помощи кинетических уравнений.
Сумма показателей степеней («д + «в + …) в кинетическом уравнении называется общим порядком реакции, а показатель степени при концентрации вещества называют порядком реакции по i-му веществу. Порядки реакций могут быть целыми, дробными и нулевыми. Наиболее часто встречаются реакции первого, второго и иногда — третьего порядков. Некоторые реакции имеют дробный порядок, например 0,5 и 1,5. Реакции более высокого порядка, чем третий, неизвестны.
В простых реакциях, например,.

они могут соответствовать стехиометрическим коэффициентам реакции, т. е. скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях с показателями, численно равными коэффициентам в уравнении реакции. Однако это редкие случаи, когда стехиометрия реакции отвечает механизму, по которому протекает реакция. Для реакций (1) и (2) общий порядок равен 2. В реакции (1) порядок по 12-1 и порядок по Н2-1, а в реакции (2) порядок по диоксиду азота равен 2.
Для гетерогенных реакций, протекающих на границе раздела фаз, количество твердого вещества, реагирующего с газом или раствором, остается постоянным. Поэтому в реакциях с участием твердых тел скорость определяется только концентрацией газов или растворенных веществ.
Единицы измерения скорости и константы скорости гетерогенной реакции отличаются от единиц измерения соответствующих величин гомогенной реакции. Так, единица измерения скорости гетерогенной реакции — моль/с, а гомогенной реакции — моль/л • с; константы скорости реакции первого порядка — м/с и соответственно с Пример 6.2. Напишем выражения скоростей реакций окисления серы (S) и ее оксида (1У) (S02), протекающих соответственно уравнениям S(T) + 02(г) S02® и 2S02® + 02(|) 2S03®.
Решение.
Для решения поставленной задачи воспользуемся законом действующих масс для химической кинетики. Согласно этому закону в выражение скорости реакции не входит концентрация веществ в твердой фазе. Поэтому скорость реакции окисления серы будет зависеть только от концентрации кислорода:
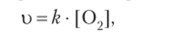
в то время как окисления ее оксида (1У) — от концентрации обоих веществ (в большей степени от концентрации оксида серы (1У)):
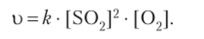
При рассмотрении кинетики химические реакции можно разделить на простые и сложные.
Простые реакции — эго реакции, в которых реагенты превращаются в продукты в результате однократного взаимодействия частиц.
Сложные реакции — это реакции, в которых реагенты превращаются в продукты в результате протекания двух и более простых реакций.
Простые реакции встречаются достаточно редко. Такие реакции чаще всего являются элементарными стадиями сложных реакций и поэтому называются элементарными реакциями.
Простые реакции классифицируют по числу частиц участвующих в превращении. Число частиц, участвующих в элементарной стадии, называется молекулярностыо реакции. Различают мономолекулярные, бимолекулярные и тримолекулярные реакции.
Следует отметить, что тримолекулярные реакции вс тречаются очень редко, так как вероятность одновременного столкновения трех частиц в 1000 раз меньше, чем столкновение двух частиц. При детальном изучении тримолекулярных реакций оказывается, что во многих случаях они состоят из двух последовательных бимолекулярных реакций: относительно медленной (лимитирующей) и очень быстрой. Молекулярность выше, чем три, практически не встречается.