Взаимное влияние атомов в молекулах, как результат образования молекулярных орбиталей

В аллил-радикале в результате сопряжения трех л-электронов спиновая плотность, создаваемая неспаренным электроном, распределяется по всем трем атомам углерода, преобладая на крайних атомах (-0,622) и составляя +0,231 на среднем атоме углерода. Эти цифры, отражающие настоящее, далеко не совершенное состояние теории квантово-химических расчетов сложных молекул, показывают, что абсолютные значения… Читать ещё >
Взаимное влияние атомов в молекулах, как результат образования молекулярных орбиталей (реферат, курсовая, диплом, контрольная)
Взаимное влияние атомов в молекулах является важнейшим свойством органических соединений, отличающих их от простых неорганических соединений. Взаимное влияние, как результат взаимодействия соседних атомов, в органических молекулах передается по цепи a-связей С-С и особенно успешно по цепи сопряженных С-С-связей и определяет избирательность реакционных центров в молекуле к тем или иным реагентам. Ранее уже упоминалось о том, что реагенты подразделяются на электронодонорные (нуклеофильные) и электроноакцепторные (электрофильные). Следует также добавить, что они могут быть электрононейтральными, когда электронодонорные и электроноакцепторные свойства скомпенсированы или отсутствуют вовсе. Кроме того, следует различать реагенты свободнорадикальные (R* или •R*), молекулярные и ионные. Классификация и свойства реагентов будут рассмотрены подробно позднее.
Взаимное влияние атомов вытекает уже из классической теории строения А. М. Бутлерова и было впервые сформулировано его учеником из Казанской школы химиков В. В. Марковниковым в его докторской диссертации «Материалы по вопросу о взаимном влиянии атомов в химических соединениях» (1869).
Впервые взаимное влияние атомов было обнаружено в молекулах алкенов и галогенопроизводных алканов. Марковников установил, что алкены с несимметричной электронной оболочкой, например СН—СН=СН,.
СН3 СН3
^С=СН2, /С=СН—СН3, присоединяют бромоводород таким СН3 СН3
образом, что НВг отдает свой атом водорода к наиболее гидрогенизированному (с максимальным числом Н-атомов) углероду:
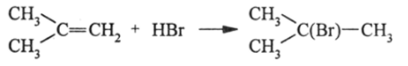
Реакция практически не идет по второму маршруту.
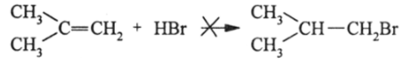
потому, что в 2-метилпропене проявляется индукционный электронный эффект метильных (алкильных) групп в отношении 4/л— орбиталей. Индукционный эффект (/-эффект) обусловлен поляризацией а-электронного облака в цепи химических связей атомов, имеющих разную электроотрицательность.
Под поляризацией молекулы понимают перераспределение электронной плотности под действием электростатических сил, при котором происходит частичное разделение «центров тяжести» положительного и отрицательного зарядов. При этом к поляризации более склонны малополярные частицы (имеющие низкие электрические моменты диполей). При этом электроотрицательностью обладают не только атомы, но и атомные группировки. Алкильные группировки обладают по отношению к а, тг-орбиталям, т. е. атомам С, находящимся в 5/?2-гибридном состоянии, электронодонорной способностью. В результате такого электронного воздействия алкильных групп связывающая 4^-орбиталь поляризована в сторону второго атома углерода.
5+ 5_
Вследствис этого возникают дробные заряды С,=^-=- С2 • Такой эффект, идущий с передачей а-электронной плотности на другие атомы, называется +/-эффектом, так как на СН3-группах возникает небольшой дробный заряд 6+. Поэтому полярная ковалентная молекула Н-Br ориентируется таким образом по отношению к я-связи, что в элементарном акте сначала возникает короткоживущее переходное состояние.
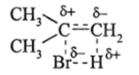
которое превращается сначала в карбкатион (СН3)2С-СН3 и Вг~, а затем они быстро и легко рекомбинируют в (СН3)2С (Вг)-СН3.
Можно также рассмотреть вопрос с точки зрения устойчивости образующегося в элементарном акте карбкатиона (наиболее энергетически выгодной делокализации положительного заряда в нем). Это более упрощенный подход, хотя суть опять же сводится к влиянию ±/-электронного эффекта, как причины устойчивости карбкатиона третичного по сравнению с первичным.
Кроме метальных и других алкильных групп +/-эффектом, т. е. способностью терять небольшую часть своей электронной плотности, обладают атомы металлов I — III групп периодической системы (Li, Са, А1 и др.), а также гидридные группировки (—SiH3, -РН2, -ВН2, -А1Н2), их алкильные производные (-SiR3, -PR2, -BR2, -A1R2 и др.).
Производные азота, кислорода и галогенов, обладающие более высокой электроотрицательностью, чем С-атомы, вызывают поляризацию, т. е. смещение электронной плотности а-электронов в сторону своих орбиталей и обладают отрицательным индукционным (-/) эффектом. Например, хлороформ СНС13 в отличие от метана обладает достаточно высокой протонодонорной способностью, так как с-орбиталь связи Н-СС13 сильно поляризована в сторону атомов хлора. Аналогично поляризующее действие трех атомов.
6- 6+.
хлора в СС13СООН передается на связь О—Н трихлоруксусной кислоты, в результате связь О-Н настолько сильно поляризуется, что СС13СООН в отличие от слабой уксусной кислоты СН3СООН становится сравнительно сильной кислотой. В этих примерах осуществляется как ближнее (СНС13), так и дальнее взаимное влияние более электроположительных или электроотрицательных атомов и их группировок на другие атомы, связанные с ними с помощью аили я-орбиталей. Установлено, что ±/-эффект слабее передается по цепи ст-связей, практически затухая на пятом-шестом атоме углерода, тогда как сопряженная л-связь свободно передает ±/-влияние на конечный атом сопряженной цепи.
Механизм легкой передачи в л-системах ±/-эффекта не исследован. Можно допустить, что он обусловлен делокализацией л-электронов, их высокой подвижностью по всей сопряженной цепи л-электронов, в результате чего (5+) — или (б-)-заряд на атоме углерода, связанный с контактным атомом функциональной группы, который наводит этот дробный заряд, «гасится» за счет смещения на этот атом обобщенного я-электронного облака, и максимальный (5±)-заряд оказывается на конечном атоме л-системы. Такое максимальное разделение (8+) — и (8-)-зарядов энергетически выгодно, так как позволяет электронам использовать максимальное пространство.
Своеобразно взаимное влияние атомов в реакциях отщепления (от англ, elimination — элиминирования) простых стабильных молекул, как сложения элементов функциональных групп, располагающихся у соседних атомов углерода:
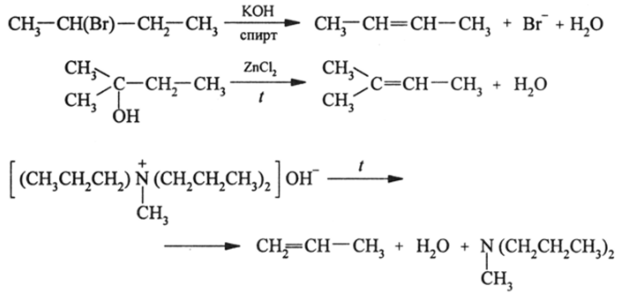
Отщепление НВг (НС1, HI) по правилу, установленному А. М. Зайцевым, учеником А. М. Бутлерова, происходит противоположно правилу присоединения Марковникова, т. е. Н-атом удаляется вместе с Вг от наименее гидрогенизированного атома углерода. Аналогично отщепляется Н20 от спиртов и гидроксидов четвертичных аминов. Это обусловлено тем, что связывающие а-орбитали вторичных С-Н-связей значительно менее стабильны (расположены выше по энергии), чем ст-орбитали первичных С-Н-связей. Еще менее стабильны третичные -«С"Норбитали, которые отдают водород уходящему партнеру (Вг, ОН) с максимальной легкостью. Энергии С-Н-связей составляют: первичной 414, вторичной 393 и третичной 376 кДж/моль. Как видно, стабильность связывающих 4^»н МО различается очень существенно.
Это обусловлено большей электроотрицательностью атома углерода (по Полингу 2,5), чем водорода (2,1). Третичный атом углерода расходует три свои связи на более электроотрицательных соседей, вторичный — на два, тогда как первичный С-атом затрачивает на углеродную связь минимум химического сродства и максимум на ЗН-атома.
Другим важным типом взаимного влияния атомов является смещение п- электронной плотности к более электроотрицательному атому или группе атомов. Если в цепи связанных атомов, кроме а-электронов, имеются также д-электроны, то введение в сопряженную тг-систему таких атомов более электронодонорного или же электроноакцепторного атома вызовет поляризацию л-системы. Например, 1,3-бутадиен, 2-метил-1,3-бутадиен (изопрен) и 2-хлор-1,3-бутадиен (хлоропрен):
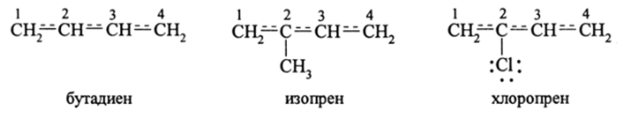
В бутадиене существует взаимное влияние a-связанных атомов углерода вследствие наличия на них рг-электронов (л-симметрии). Как следует из изложенного выше, такое взаимное влияние ненасыщенных атомов называется л, л-сопряжением, или л-сопряжением.
Введение
в такую сопряженную систему а-электронодонорной СН3-группы поляризует л-систему и приводит к возрастанию порядков связей в сопряженной цепи, тогда как поляризация а, л-системы бутадиена при введении сильного электронного акцептора (атома С1), обладающего одновременно способностью вступать в тг-сопряжение, частично передавая свою электронную пару на орбиталь, приводит в конечном итоге к уменьшению порядков связей в сопряженной л-системе. Отсюда следует, что -/-эффект атома хлора по отношению к диеновой сопряженной л-системе значительно больше, чем его +С-эффект (положительный эффект сопряжения). Поляризация сопряженных л-систем электронодонорными (ЭД) или электроноакцепторными (ЭА) заместителями изменяет также и ИСВ и приводит к появлению небольших дробных зарядов на атомах. Наибольший отрицательный (-СН3) или положительный (-С1) заряд будет расположен на С4 бутадиеновой цепи.
Из приведенных примеров можно сделать вывод о существовании в органических молекулах взаимного влияния химически связанных атомов нескольких типов. Это влияние выражается в виде различных электронных эффектов (электронных влияний, действий, смещений), действия друг на друга электрических полей близко расположенных атомов (эффект поля, ±F- эффект) и пространственных препятствий (стерических эффектов, ± ?-эффект), возникающих в химических реакциях в результате экранирования атомами реакционных центров молекул.
Принято различать индукционный эффект (±/-эффект) и эффект сопряжения (±С-эффект). Индукционные эффекты, обозначаемые знаками (+) или (-) в зависимости от а-электронодонорной или акцепторной способности, имеют яркое проявление в кислотно-основных свойствах молекул. Так, все галогеноуксусные кислоты сильнее уксусной, так как галогены поляризуют все ст-связи по цепи Г—СН^—, вызывая понижение порядка связи О.
О-Н и повышение ее полярности, а следовательно, способности к отщеплению Н+. Поляризация связи О-Н, N-H, S-H называется ее протонизацией и приводит к увеличению кислотной диссоциации (росту КЛ — константы кислотной диссоциации). Аналогично действуют все заместители — электронные акцепторы. Все электронные доноры, замещающие Н-атом в метильной группе уксусной кислоты, действуют противоположно, понижая КЛ. Действие электроноактивных заместителей (доноров и акцепторов, т. е. функциональных групп Ф, на основные центры (—В) молекул простого типа (В—R—Ф) противоположно действию на кислотные центры (-О-Н и др.). Аналогично действие ЭДи ЭА-заместителей на реакции нуклеофильного замещения, когда одна электронодонорная функциональная группа (Ф') замещается другой.
(Ф"):

В этом случае расщепление связи углеводородного остатка ® с контактным атомом функциональной группы (Ф') происходит за счет уменьшения порядка связи Ф^-R и ее поляризации в результате атаки Ф" своей электронной парой:
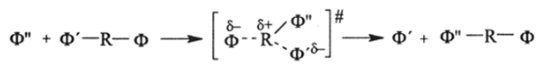
В качестве уходящей группы Ф' могут быть любые группы основной природы, такие, как СГ, Вг", Г, NCS", NOj, HSO; и т. д., а в качестве вступающей группы могут быть уже перечисленные (Ф'), а также такие, как NH2, SH', SR", RCOO", HSOj, НРО^ и им подобные, т. е. более сильные нуклеофилы.
В качестве сопутствующей группы (Ф), ковалентно связанной с углеводородным остатком R неароматической природы, могут выступать любые заместители. Обычно — это Н-атомы, СН3 и другие алкилы, C6Hsи остатки любых других аренов. Более сложные случаи замещения мало исследованы и не разработаны теоретически.
В молекулах и других молекулярных частицах (ионах, свободных радикалах), содержащих в цепи более трех я-орбиталей, возникают эффекты сопряжения. Они обусловлены, как было указано на примере замещенных бутадиена, взаимодействием двух или нескольких близких или различных по природе л-систем (СН2=СН-, СН=Сгрупп) или же я-систем (например, СН2=СН-, QH5- и т. п.) с химически активными атомами или группами атомов, у которых есть орбитали: 1) pz- или dK-; 2) заполненные одним электроном или парой электронов; 3) свободные от электронов. Примерами таких.
•.
атомов или их групп могут бытьСН2, -СН2, -СН2, — СН-, -СН, ?
— СН -, многочисленные гетероатомы (неметаллов и металлов) и их группировки, например, =0, -0-, «ОН, -NH2, -NH-, -N=, -SH, -Sи др.
Примеры пк- и </л-сопряженных систем уже приводились. Из ряда наиболее распространенных и важных назовем такие, как:
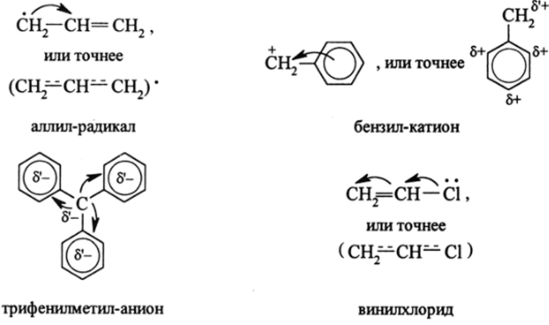
В аллил-радикале в результате сопряжения трех л-электронов спиновая плотность, создаваемая неспаренным электроном, распределяется по всем трем атомам углерода, преобладая на крайних атомах (-0,622) и составляя +0,231 на среднем атоме углерода. Эти цифры, отражающие настоящее, далеко не совершенное состояние теории квантово-химических расчетов сложных молекул, показывают, что абсолютные значения величин расчет дать не может. Приведенные цифры сами по себе бессмысленны, если даже не абсурдны, так как естественно, что спиновая плотность, создаваемая в сопряженной системе единичным неспаренным электроном не должна прерываться ни на одном атоме и в сумме должна равняться единице. Из приведенных цифр следует, что электрон расщепляется на две части, которые не взаимодействуют, так как на среднем атоме углерода электронной плотности от неспаренного электрона нет. Но, несмотря на несовершенство современного расчетного аппарата сложных молекул, приведенные цифры показывают, что сумма спиновых плотностей (2−0,622) — 0,231 близка к 1 и что электрону энергетически выгоднее занимать максимальное пространство с максимальным распределением электронной спиновой плотности на крайних атомах сопряженной системы.
Еще труднее осмыслить результаты расчета распределения спиновой плотности в бензильном радикале.
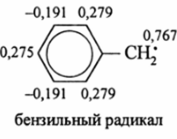
Из приведенной схемы видно, что дефицит электронной плотности при расчете достиг 0,2 ед. заряда электрона.
Радикал за счет этого значительно стабилизируется. В бензил-катионе вакантная р.-орбиталь взаимодействует с ВЗМО, т. е. Ч*, — орбиталью с перекачкой аи я-электронной плотности из бензольного ядра, особенно из орто— и лдря-положений. При этом 5' + 38 = 1. В результате такого взаимного влияния а-, я-орбиталей реакционная способность бензольного ядра с электрофильными реагентами уменьшается сильнейшим образом, а с нуклеофильными, наоборот, сильно возрастает. Делокализация (+)-заряда рг
орбитали заметно стабилизирует карбкатион С6Н5СН2.
В трифенилметил-анионе (С6Н5)3С‘, имеющем плоское строение и яркую (вишнево-красную) окраску в результате ля-сопряжения заполненной рг— орбитали метильного атома углерода с НВМО (т. е. Ч**э) бензольных ядер, отрицательный заряд делокализуется по орто— и лярд-положениям бензольных ядер. За счет этого взаимного влияния атомов карбанион сильно стабилизируется, а бензольные ядра приобретают способность очень легко взаимодействовать даже со слабыми электронными акцепторами (12, пиридин, C6H5N02 и др.).
Винилхлорид является примером mt-сопряжения между несвязывающей орбиталью (рС|, несущей пару р.-электронов, и 71- связью. В результате связь СС 1 становится заметно прочнее (на 12 кДж/моль) и чуть короче. Атом галогена становится малореакционноспособным в реакциях замещения со щелочью. Ниже приведена энергетическая диаграмма связывающих МО винилхлорида (рис. 2.21). Энергетический выигрыш mt-сопряжения возникает в.
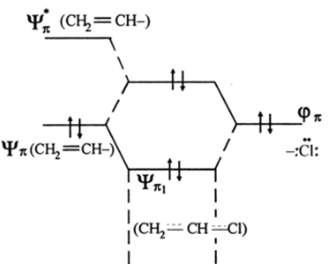
Рис. 2.21. Связывающие МО винилхлорида (лл-сопряжение)
результате возрастания так называемой области пребывания mt-электронов за счет их делокализации. Для л-электронов СН2=СНслабым резервуаром делокализации может быть З^-орбиталь хлора. Аналогичная винилхлориду ситуация mt-сопряжения возникает в молекуле хлорбензола QHs-Cl, анилина СбН5-НН2, фенола QHs-OH:
где X — гетероатом.
Серьезного внимания заслуживает третий тип взаимного влияния атомов в молекулах, который получил название эффекта поля (^-эффект). Концепция эффекта поля разработана слабее, чем /- и Сэффектов.
В настоящее время под эффектом поля понимается воздействие статического электрического заряда ионизированных атомов, входящих в состав молекулы, или больших дробных зарядов диполей поляризованных адсвязей на соседние или близлежащие атомы той же самой молекулярной частицы.
Примером могут быть молекулы с семиполярной связью, например + +.
СН3— S— СН3 (диметилсульфоксид), (C2H5)3N—О (оксид триэтиламина),.
о*.
молекулы с полным разделением зарядов за счет сильных внутримолекуляр;
+ _.
ных кислотно-основных взаимодействий, как, например, NH—СН2— СОО (глицин) и все другие аминокислоты и комплексоны, сильно полярные молеn-l/2.
+ + кулы, например, C6H—_½ (нитробензол) или ионы (C2H5)4N (тетраэтил;
аммоний), C2H5—N=N (бензолдиазоний), (С2Н5)2ОН (диэтилгидроксоний),.
ионы комплексных соединений — катионов и анионов, в числе которых можно назвать [Со (ЫН2СН3)6]3+ (гексаметиламинат кобальта), [Fe (CN)6]*~ (феррициа;
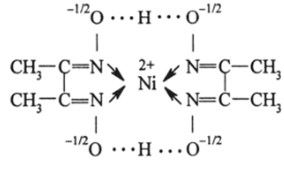
нид), Fe (C5H5)2 (феррициний-катион), (диметилглиоксимин никеля).
Число известных соединений подобной структуры бесконечно велико. Под влиянием электрического поля точечных носителей заряда соседние химические связи поляризуются, в результате чего изменяются химические свойства связанных атомов и атомных групп, находящихся в непосредственной близости от источника заряда. При этом F-эффект обладает значительно большим дальнодействием, чем ковалентный /-эффект. Влияние электрического заряда распространяется на расстояние до 3 нм.
В целом ряде сложных молекул, содержащих в сопряженной системе функциональные группы, склонные к ионизации (кислотно-основной диссоциации) в растворах полярных растворителей, способных к донорноакцепторным взаимодействиям, заряд делокализуется по всей молекуле или отдельным ее частям.
Примером простой частицы подобного рода может быть диметилглиоксимин-анион.
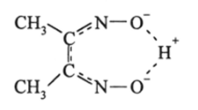
В этих случаях возникает эффект поля, однако механизм его действия сложен и здесь не рассматривается.
Взаимное влияние аналогичным образом проявляется как в органических, так и в неорганических комплексных соединениях. В последних взаимное влияние атомных и молекулярных орбиталей валентной оболочки получило название электронных эффектов координации. Эти эффекты обусловлены воздействием на координированные лиганды таких видов координации онной химической связи, как о-связь, дативная к-связь, обратная дативная п-связь, а также действием поля катиона. Они получили в отечественной литературе название с-эффекта координации, %-эффекта координации, обратного п-эффекта координации и эффекта заряда.
В результате действия этих эффектов при образовании комплексного соединения (М + L ML) из иона металла (М — заряд опущен) и лиганда (L — заряд опущен) свойства лигандов L в координированном состоянии могут сильно отличаться от свободных L:
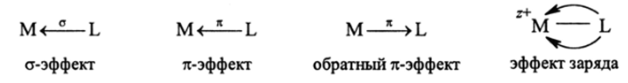
Этот факт широко используется в катализе промышленных и лабораторных реакций. В этих случаях за счет введения солей-металлов в сферу реакции образуются комплексные соединения и такой катализ получил название «комплексного катализа».