Концентрация.
Химия

Ообозначение концентрации буквой М используется для растворов, точное значение концентрации которых не требуется или приблизительно кратно 10. В остальных случаях рекомендуется использовать общепринятые обозначения, например 0,0934 моль/л. Некоторые соли содержат в своем составе воду, например медный купорос, или пятиводный сульфат меди CuS04−5H20. При приготовлении растворов таких солей следует… Читать ещё >
Концентрация. Химия (реферат, курсовая, диплом, контрольная)
Важнейшей характеристикой раствора является его состав, который выражается концентрацией растворенных веществ. Остановимся на наиболее часто используемых в химической практике способах количественного выражения состава раствора.
Массовая концентрация — отношение массы компонента к объему системы (единица измерения г/л).
Мольная концентрация С — отношение количества (моль) вещества к объему раствора. Мольная концентрация — это число молей растворенного вещества в 1 л раствора; она равна отношению числа молей п растворенного вещества к объему V раствора в литрах:
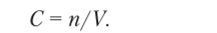
Единица измерения мольной концентрации — моль/л. Иногда мольную концентрацию обозначают буквой М, например:
- • 2 М — двухмольный раствор (2 моль/л);
- • 1 М — одномольный раствор (1 моль/л);
- • 0,1 М — децимольный раствор (0,1 моль/л);
- • 0,01 М — сантимольный (0,01 моль/л).
Ообозначение концентрации буквой М используется для растворов, точное значение концентрации которых не требуется или приблизительно кратно 10. В остальных случаях рекомендуется использовать общепринятые обозначения, например 0,0934 моль/л.
Моляльная концентрация т — это отношение числа молей растворенного вещества п к массе растворителя q:
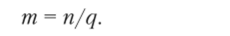
Единица измерения моляльной концентрации — моль/1000 г или моль/кг (растворителя).
Этой концентрацией пользуются в точных исследованиях, так как численное значение концентрации не зависит от температуры.
Концентрацию раствора иногда выражают массой вещества, растворенного в 100 г растворителя или в 1 л раствора. Титр — число граммов растворенного вещества в 1 мл раствора.
Часто для указания содержания растворенного вещества используют безразмерные величины содержания компонента в системе.
Массовая доля (долевая концентрация по массе) — отношение массы вещества к массе раствора. Массовая доля выражает содержание растворенного вещества в долях единицы.
Если массовую долю умножить на 100, то получится процентная концентрация (по массе). Так, 20%-ный раствор — это раствор, в 100 г которого содержится 20 г растворенного вещества. Сумма массовых процентов всех растворенных веществ и растворителя равна 100%.
Мольная доля Nt — отношение количества г-ro компонента ni к количеству всех компонентов системы (и, + п2 + … + п( + … + nk), или отношение числа молей одного компонента к общему числу молей всех компонентов системы:
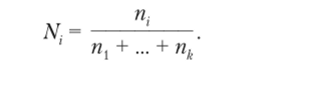
В формулу входит число молей воды, если обсуждается водный раствор, или молей другого растворителя. Сумма мольных долей всех компонентов равна единице.
Часто приходится иметь дело с двухкомпонентными растворами, состоящими из растворителя, А и растворенного вещества Б. Мольная доля компонента, А равна
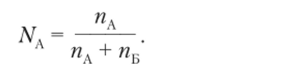
Мольная доля компонента Б равна.
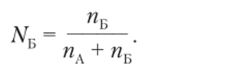
Мольная доля в двухкомнонентной системе удобна для графического представления зависимости свойств раствора от содержания компонентов.
Некоторые соли содержат в своем составе воду, например медный купорос, или пятиводный сульфат меди CuS04-5H20. При приготовлении растворов таких солей следует учитывать содержащуюся в них воду, которая при растворении соли переходит в раствор.
При вычислении концентрации часто требуется знание плотности раствора.
Пример 1. Рассчитаем, сколько граммов гидроксида калия КОН потребуется для приготовления 0,5 л 20%-ного раствора КОН. По справочнику находим плотность 20%-ного раствора КОН: 1,176 г/мл при 20 °C. Определяем массу 0,5 л 20%-ного раствора КОН: 500 1,176 = = 588 г. Поскольку в 100 г 20%-ного раствора содержится 20 г растворенного вещества, то 588 г этого раствора будет содержаться 588 -20/100 = 117,6 г КОН.