Математическое описание реакции первого, второго, третьего и нулевого порядков

Это кинетическое уравнение реакции первого порядка. Это кинетическое уравнение реакции второго порядка. Размерность константы реакции третьего порядка; Где С0 — начальная концентрация моль/л; С — концентрация к моменту времени t. Мономолекулярная реакция. Если, то скорость реакции: Тримолекулярная реакция. Бимолекулярная реакция. Или (3.3). T0=0 до t. Если. 3.10). 3.9). 3.7). 3.6). 3.5). 3.4… Читать ещё >
Математическое описание реакции первого, второго, третьего и нулевого порядков (реферат, курсовая, диплом, контрольная)
Мономолекулярная реакция
Согласно закону действующих масс, скорость мономолекулярной химической реакции равна.
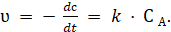
(3.2).
Это кинетическое уравнение реакции первого порядка.
Выражение для расчета константы скорости реакции первого порядка получают интегрируя последнее уравнение в пределах от С0 до С и от.
t0=0 до t.
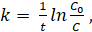
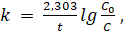
или (3.3).
где С0 — начальная концентрация моль/л;
С — концентрация к моменту времени t.
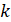
Константа реакции первого порядка имеет размерность обратного времени-t-1,(с-1, мин-1 и т. д.).
Бимолекулярная реакция
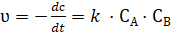
. (3.4).
Это кинетическое уравнение реакции второго порядка.
Если.
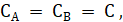
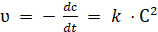
(3.5).
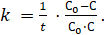
(3.6).
Размерность константы реакции второго порядка зависит от способа выражения концентрации растворов.
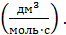
Тримолекулярная реакция.
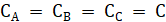
Если, то скорость реакции:
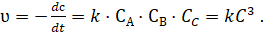
(3.7).
Это кинетическое уравнение реакции третьего порядка, для которого константа скорости рассчитывается по формуле:
Размерность константы реакции третьего порядка ;
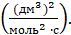
В реакциях нулевого порядка скорость реакции от концентрации не зависит.
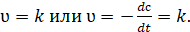
(3.9).
Это имеет место в тех случаях, когда снижение концентрации вещества в результате протекания химической реакции восполняется доставкой его по другой фазе. Нулевой порядок наблюдается также, если скорость реакции лимитируется подачей энергии, необходимой для активации реагирующих молекул. Часто в каталитических реакциях скорость определяется концентрацией катализатора и не зависит от концентрации реагирующих веществ.
Интегрирование уравнения (3.9) дает следующее уравнение:
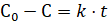
. (3.10).
Из уравнения (3.10) видно, что концентрация реагирующего вещества линейно убывает со временем. Размерность константы реакции нулевого порядка совпадает с размерностью скорости реакции.