Плутоний.
Фундаментальная радиохимия

Плутоний-242 (Ti/2 = 373 300 л), а-излучатель (4,88 МэВ), удельная активность 242Ри 4,93 мКи/г (в 15 раз меньше радиоактивности 239Ри). Подвержен самопроизвольному делению. Интенсивность испускания нейтронов 242Ри 840 000 дел/(с • кг) (вдвое выше, чем у 240Ри). Скорость самопроизвольного деления 2,9 • 106 делений на 1 г/ч соответствует периоду полураспада для этого процесса 6,7* 1010 л. Тепловыми… Читать ещё >
Плутоний. Фундаментальная радиохимия (реферат, курсовая, диплом, контрольная)
Плутоний (plutonium) Pu — элемент семейства актинидов, 7-й период периодической системы элементов, Z = 94, атомная масса 244,0642. Изотоп 238Рн открыт Г. Сиборгом, Э. Макмилланом, Дж. Кеннеди и А. Уолхом в декабре 1940 г. в Беркли при бомбардировке мишени из 238U дейтронами, ускоренными на шестидесятидюймовом циклотроне до энергии 22 МэВ. При этом был получен 239Np, который путем (3-распада перешел в 238Ри. В 1941 г. синтезирован более важный изотоп плутония — 239Ри.
В настоящее время известно 19 изотопов плутония. Самый легкий из них 228Ри (Г½ = 1,1 с), самый тяжелый 2/*7Ри (Г½ = 2,27 дня) имеет 8 ядерных изомеров. Наиболее устойчив изотоп 244Pu 2 = 8,05−107 л), следы его обнаружены в природе.
Для синтеза плутония используются заряженные частицы большой энергии, такие, как дейтроны и ионы гелия, ускоренные в циклотроне. Легкие изотопы обычно можно получить путем реакции с заряженными частицами. Более тяжелые изотопы получаются в результате нейтронных реакций в ядерных реакторах. Средняя энергия a-излучения изотопов 234Pu, 235Pu, 236Pu, 237Pu; 338Pu; 239Pu, 240Pu, 241Pu, 242Pu, 244Ри равна соответственно 3,78 10 1,61−10 4; 5,85; 2,74 • 10~4; 5,58;
5,23; 5,24; 1,22 • 10 4; 4,97; 4,65 МэВ. Легкие изотопы плутония (232Pu, 234Pu, 235Pu, 237Ри) претерпевают электронный захват.
Плутоний-236 (Т½ = 2,851 л), а-излучатель: 5,72 МэВ (30,56%) и 5,77 МэВ (69,26%), дочерний нуклид 232U, удельная активность 540 Ки/г. Вероятность спонтанного деления 10 6 Скорость самопроизвольного деления 5,8 -107 делений на 1 г/ч соответствуют периоду полураспада для этого процесса 3,5 -109 л.
23сРн может быть получен по реакциям:

Этот изотоп образуется также при распаде а-излучателя 240Ст (Г½ = 27 дней) и р-излучателя 23C" 'Np (Г½ = 22 ч).
236Ри распадается, но следующим направлениям: а-распад, вероятность 100%, энергии а-частиц: 5,721 МэВ (30,56%), 5,767 МэВ (69,26%), рентгеновское излучение 13,5 (4,6%), 16,41 (1,07%), -17,1 (4,5%), 20,5 (1,2%) кэВ и др. Вероятность самопроизвольного деления менее 110 6%.
Плутоний-237 (Г, 2 = 45,2 дня), дочерний продукт 237Np. Может быть получен бомбардировкой природного урана ионами гелия с энергией 40 МэВ по ядерным реакциям:
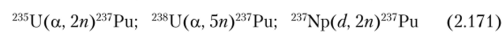
Он в небольших количествах образуется и при облучении урана реакторными нейтронами.
Основной тин распада — электронный захват (99%, характеристическое рентгеновское излучение, дочерний продукт 237Np), но имеет место а-распад с образованием 233U и слабое у-изл учение.
Плутоний-238 — первый открытый изотоп плутония (Г½ = 87,74 л, а-распад). Для его синтеза использовалась реакция:
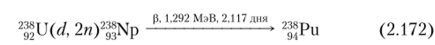
- 238Ри образуется в результате следующих распадов:
- • Рраспад нуклида 238Np:

• р'-распад нуклида 238Ат:

• а-распад нуклида 242Ст:

238Рн генерируется в любом ядерном реакторе, работающем на природном или малообогащенном уране, содержащем в основном изотоп 238U. При этом происходят следующие ядерные реакции:

Он также образуется при бомбардировке урана ионами гелия с энергией 40 МэВ:
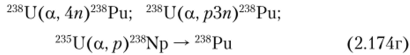
Весовые количества изотопно чистого 238Ри получают путем облучения нейтронами 237Np, который в свою очередь добывают из ОЯТ.
При a-раснаде 238Ри (вероятность 100%, энергия распада 5,593 МэВ) образуется 234U (Г½ = 2,455 • 105 л).
Вероятность спонтанного деления 1,9 • 10 7%.
238Ри — a-излучатель (энергии 5,495 (76%), 5,453 (24%) и 5,351 (0,15%) МэВ, слабый у-излучатель (энергии от 0,044 до 0,149 МэВ). Активность 1 г этого нуклида составляет примерно 633,7 ГБк (удельная активность 17 Ки/г); каждую секунду в этом же количестве вещества происходит около 1200 актов спонтанного деления.
Скорость самопроизвольного деления 238Ри 5,1 • 106 делений на 1 г/ч соответствует периоду полураспада для этого процесса 3,8 • 1010 л. При этом развивается очень высокая тепловая мощность — 567 Вт/кг. Сечение захвата тепловых нейтронов, а = 500 барн, сечение деления под действием тепловых нейтронов примерно равно 18 барн. Он обладает очень сильной а-радиоактивностью (в 283 раза сильнее 239Ри), что делает его много более серьезным источником нейтронов от реакций (а, /?).
При а-распаде 238Ри выделяется 5,5 МэВ энергии. 1 кг 238Ри развивает тепловую мощность порядка 560 Вт. Максимальная мощность такого же по массе химического источника тока — 5 Вт. Существует немало излучателей с подобными энергетическими характеристиками, но одна особенность 238Рн делает этот изотоп незаменимым. Обычно а-распад сопровождается сильным у-излучением. 238Ри — исключение. Энергия у-квантов, сопровождающих распад его ядер, невелика, защититься от нее несложно: излучение поглощается тонкостенным контейнером. Мала и вероятность самопроизвольного деления ядер этого изотопа.
Плутоний-239 — практически самый важный изотоп, 2,44 • 104 л. Входит в радиоактивное семейство Ап + 3, называемое рядом актиния (или рядом 235U — дочернего элемента 239Ри). Известен единственный изомер 239отРи (энергия возбуждения — 391,584 кэВ, Т[/2 =193 нс).
В природе плутоний встречается в чрезвычайно малых количествах в урановых рудах. Радиогенный 239Ри образуется из 238U при захвате нейтронов, возникающих при спонтан;
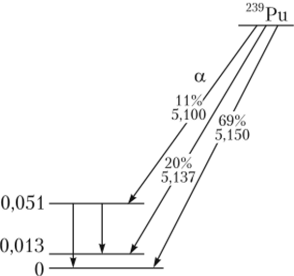
Рис. 2.23. Схема распада 239Ри ном делении урана (235U и 238U) и в результате реакций (а, п) на легких элементах, входящих в состав руд; еще одним источником нейтронов является космическое излучение. Активность 1 г этого нуклида составляет около 2,3 ГБк.
Плутоний-239 образуется в результате следующих распадов: рраспад нуклида 239Np (Ti/2 = 2,356 дня); К-захват, осуществляемый нуклидом 239Аш (7, 2 = 11,9 ч); а-распад 243Ст (Т½ = 29,1 л).
Основным распадом 239Ри является а-распад (вероятность 100%, энергия распада 5,244 МэВ), продукт распада 235U. Испускает а-частицы с энергиями: 5,106 МэВ (в 11,94% случаев); 5,144 МэВ (в 17,11% случаев); 5,157 МэВ (в 70,77% случаев) и слабое у-излучсние (рис. 2.23). Он также способен на самопроизвольное деление (вероятность 3,1−10 10%). Скорость самопроизвольного деления: 36 делений на 1 r/ч соответствуют периоду полураспада для этого процесса 5,5 • 1015 л. 1 кг 239Ри эквивалентен 2,2−10' кВт-ч тепловой энергии.
239Ри делится под действием нейтронов любых энергий, способен к цепной реакции деления, используется в ядерных реакторах в качестве горючего и в атомных бомбах в качестве ядерного заряда. Поперечное сечение захвата тепловых нейтронов а = 271 бари. Он — первый искусственный элемент, производство которого началось в промышленных масштабах. 239Рп получается в ядерных реакторах по реакции:

Поперечное сечение реакции примерно равно 455 барн.
239Ри образуется также при бомбардировке урана дейтронами с энергией выше 8 МэВ по ядерным реакциям:
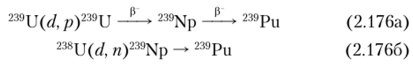
а также при бомбардировке vpana ионами гелия с энергией 40 МэВ:
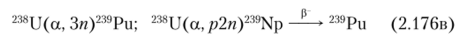
Когда ядро 239Ри делится нейтронами на два осколка примерно равной массы, выделяется около 200 МэВ энергии. Способен поддерживать цепную реакцию деления.
Относительно короткий период полураспада 239Ри (по сравнению с 235U) подразумевает значительное выделение энергии при радиоактивном распаде (1,92 Вт/кг). Хорошо теплоизолированный блок плутония разогревается до температуры свыше 100 °C за 2 ч и вскоре до точки перехода а- в [3-фазу. Такой разогрев представляет проблему для конструирования оружия из-за изменения объема, фазовых переходов плутония. Удельная активность 239Ри 61,5 мКи/г. гзэрн легко делится тепловыми нейтронами. Делящийся изотоп 239Ри при полном распаде дает тепловую энергию, эквивалентную 25 000 000 кВт-ч/кг; поперечное сечение деления на медленных нейтронах 748 барн, сечение радиационного захвата 315 барн.
239Рп имеет большие сечения рассеивания и поглощения, чем уран, и большее число нейтронов при делении (3,03 нейтрона на один акт деления по сравнению с 2,47 у 235U), и соответственно меньшую критическую массу. Чистый 239Ри имеет среднюю величину испускания нейтронов от спонтанного деления, примерно равную 30 нейтр/(с-кг).
Плутоний-240, а-расиад, Г, 2 = 6564 л, удельная активность 0,23 Ки/г. Скорость самопроизвольного деления 1,6−106 делений на 1 г/ч соответствует периоду полураспада 1,2−10″ л. 24,Рп имеет втрое меньшее эффективное сечение захвата нейтрона, чем у 239Ри, и в большинстве случаев превращается в 241 Ри.
- 240Ри образуется при распаде некоторых радионуклидов: (3 -распад 240Np (Т½ = 61,9 м), (3+-распад 240Ат (Г½ = 50,8 ч), а-распад 244Ст (Г|/2 =18,1 л).
- 240Ри претерпевает а-распад (Г½ = 6564 л) с образованием 236U (Т[2 = 23,42−107 л). Энергия а-раснада 5,255 МэВ, а-частицы с энергиями 5,168 (72,8%), 5,123 (27,10%) МэВ. Этот изотоп способен и к спонтанному делению (вероятность 5,7 • 10 е).
- 240Ри может быть получен по следующим ядерным реакциям:

— облучение тепловыми нейтронами;

— при облучении ионами гелия с Е = 40 МэВ.
В атомном реакторе 240Ри образуется при захвате нейтрона ядром 239Рп. В урановом топливе содержание 240Ри увеличивается в процессе работы реактора. В отработанном топливе ядерного реактора 70% 239Ри и 26% 240Ри, что затрудняет изготовление атомного оружия, поэтому оружейный плутоний получается на специально предназначенных для этого реакторах путем переработки урана после 10 дней облучения.
Плутоний-240 — основной изотоп, загрязняющий оружейный 239Ри. Уровень его содержания важен из-за интенсивности спонтанного деления — 415 000 делений/с-кг, при этом испускается 1 000 000 нейтр/с-кг, что в 30 000 раз больше, чем у 239Ри. Наличие 1% 240Ри делает неприменимой пушечную схему атомной бомбы — возможна преждевременная детонация ядерного заряда, и он будет распылен до того, как взорвется основная масса заряда. Пушечная схема возможна только при 100%-ном содержании 239Ри; добиться этого практически нереально. Поэтому плутониевые бомбы собирают по имплозивной схеме, которая допускает использование плутония, довольно сильно загрязненного изотопом 240Ри (примерно до 7% 240Pu). 240Ри хорошо делится, несколько лучше 235U. Однако высокие концентрации такого изотопа увеличивают требуемую критическую массу, создавая проблему нейтронного фона. Вследствие короткого времени жизни (¼ от 239Ри) тепловой выход выше и составляет 7,1 Вт/кг, обостряя проблему перегрева. Удельная активность 240Ри 227 мКи/г. Содержание 240Ри в оружейном (0,7%), в топливном (7—19%) и реакторном (>19%) плутонии. В топливе для тепловых реакторов присутствие 240Ри нежелательно, но этот изотоп может служить топливом в быстрых реакторах.
240Ри имеет втрое меньшее эффективное сечение захвата нейтрона, чем 239Ри, и в большинстве случаев превращается в 241Ри.
Плутоний-241, Г½ = 14 л, дочерний продукт 241Аш, р'- (99%, ?рмакс — 0,014 МэВ), а- (1%, две линии: 4,893 (75%) и 4,848 (25%) МэВ) и у-излучатель, удельная активность 241Pu 106 Ки/г. Получается при сильном облучении плутония нейтронами, а также в циклотроне по реакции 238U (a, /?)241Ри. Этот изотоп делится нейтронами любых энергий (поперечное сечение поглощения нейтронов у 241 Ри на 1/3 больше, чем у 239Ри, сечение деления тепловыми нейтронами составляет порядка 1000 барн, вероятность деления при поглощении нейтрона 73%), имеет низкий нейтронный фон и умеренную тепловую мощность и потому непосредственно не влияет на удобство применения плутония. Он распадается через 14 лет в 241Ат, который очень плохо делится и создает много тепла: 110° Вт/кг. Если оружие первоначально содержит 241 Ри, то через несколько лет его реакционная способность падает, что уменьшает мощность заряда и увеличивает самонагрев. Сам24 Фи сильно не нагревается (всего 3,4 Вт/кг), несмотря на свой очень короткий период полураспада из-за очень слабого р-распада. При поглощении нейтрона ядром 24Фи, если оно не делится, то переходит в 242Ри.
Плутоний-242 (Ti/2 = 373 300 л), а-излучатель (4,88 МэВ), удельная активность 242Ри 4,93 мКи/г (в 15 раз меньше радиоактивности 239Ри). Подвержен самопроизвольному делению. Интенсивность испускания нейтронов 242Ри 840 000 дел/(с • кг) (вдвое выше, чем у 240Ри). Скорость самопроизвольного деления 2,9 • 106 делений на 1 г/ч соответствует периоду полураспада для этого процесса 6,7* 1010 л. Тепловыми нейтронами не делится, но способен к делению под действием быстрых нейтронов. Наличие 242Ри серьезно увеличивает требуемую критическую массу и нейтронный фон. Имея большую продолжительность жизни и маленькое сечение захвата, 242Ри накапливается в переработанном реакторном топливе. В реакторе 242Ри образуется при захвате нейтронов 239Pu, 240Ри и24Фи. Поперечное сечение реакции 24Фи(п, у)242Ри на медленных нейтронах составляет примерно 250 барн. 242Ри редко захватывает нейтроны и тепловыми нейтронами не делится и потому «выгорает» в реакторе медленнее остальных изотопов; он сохраняется и после того, как остальные изотопы плутония почти полностью перешли в осколки или превратились в 242Pu. 242Ри важен как «сырье» для накопления высших трансурановых элементов (от калифорния до эйнштейния) в ядерных реакторах. 242Ри не сгорает в тепловом реакторе, его используют как топливо в быстром реакторе.
Плутоний-243 (Г½ = 4,956 ч), |3 — (энергия 0,56 МэВ) и у-излучатель (несколько линий в интервале 0,09—0,16 МэВ). Поперечное сечение реакции 242Pu (n, y)243Pu на медленных нейтронах 100 барн. Образуется при р-распаде 243Ат, может быть получен облучением нейтронами 242Ри. Из-за своего короткого периода полураспада присутствует в облученном реакторном топливе в незначительных количествах.
Плутоний-244 (Г½ = 8,0 • 107 л), а-излучатель, Еа = 4,6 МэВ, способен на самопроизвольное деление, удельная активность 0,18 Ки/г, поперечное сечение захвата тепловых нейтронов, а = 19 барн. Это не только самый долгоживущий изотоп плутония, но и самый долгоживущий из всех изотопов трансурановых элементов. Удельная активность 244Ри в 3000 раз меньше удельной активности 244Ри. В отработанном урановом топливе 244Pu мало, так его предшественник 242Ри захватывает нейтрон и переходит в 243Ри, который быстро (Т{,2 = 5 ч) p-распадом переходит в 243Ат. Поэтому в реакторе 211Ри накапливается в незначительных количествах. Однако при взрыве плутониевой атомной бомбы возникает некоторое количество 244Ри.
Еще более тяжелые изотопы плутония подвержены р-распаду, и их время жизни лежит в интервале от нескольких дней до нескольких десятых секунды. В термоядерных взрывах образуются все изотопы плутония, вплоть до 257Ри. Но их время жизни — десятые доли секунды, и изучить многие короткоживущие изотопы плутония пока не удалось.
Ядерная индустрия выпускает различные сорта плутония (табл. 2.6). К концу XX в. в мире было произведено в общей сложности порядка 1300 т плутония, из которого около 300 т для оружейного использования, остальное — побочный продукт АЭС (реакторный плутоний).
Согласно классификации, принятой в США (табл. 2.6), изотопные составы плутония подразделяются:
- • плутоний оружейного качества (WGPu), если содержание изотопа 240Ри составляет менее 7% (в некоторых зарядах используется плутоний с содержанием 240Ри менее 1,7%);
- • плутоний «топливного» качества (FGРи), если содержание изотопа 240Ри составляет от 7 до 18%;
- • плутоний «реакторного» качества (RGРи), если содержание изотопа шРи составляет более 18%.
Таблица 2.6
Характеристика типов плутония.
Сверхчистый плутоний. | Практически чистый 239Ри (содержание нерасщепляющегося 240Ри < 3%). |
Оружейный плутоний. | Содержание 240Ри <1% |
Плутон и й, ис пол ьзуемы й в виде реакторного топлива. | Содержание 240Ри от 7 до 18%. |
Реакторный (энергетический) плутоний. | Содержание 240Ри > 18%. |
Оружейный плутоний отличает от реакторного не столько степень обогащения и химический состав, сколько изотопный состав, зависящий как от времени облучения урана нейтронами, так и от времени хранения после облучения. Особенно важно содержание изотопов 240Ри и 241 Ри. Хотя атомную бомбу можно создать при любом содержании этих изотопов, тем не менее наличие 240Ри в 239Ри определяет качество оружия, ибо именно от него зависит нейтронный фон и такие явления, как рост критической массы и тепловой выход. Нейтронный фон влияет на взрывное устройство ограничением общей массы плутония и необходимостью достижения высоких скоростей имплозии. Поэтому бомбы старых схем требовали низкого содержания 240Ри. Но в проектах «высокого» класса используется плутоний любой чистоты. Поэтому термин «оружейный плутоний» военного значения не имеет; это — экономический параметр: «высокий» класс бомбы существенно дороже «низкого».
С ростом доли 240Ри, стоимость плутония падает, а критическая масса увеличивается. Содержание 7% 240Ри делает стоимость плутония минимальной. Средний состав оружейного плутония: 93,4% 239Ри, 6,0% 240Ри и 0,6% 241 Ри. Тепловая мощность такого плутония 2,2 Вт/кг, уровень спонтанного деления 27 100 дел/с. Этот уровень позволяет использовать в оружии 4 кг Ри с низкой вероятностью преддетонации в хорошей имплозионной системе. Через 20 лет большая часть 241 Ри превратится в 241Ат, существенно увеличив тепловыделение до 2,8 Вт/кг. Поскольку 241Ри прекрасно делится, а 241Аш — нет, эго приведет к снижению «запаса реактивности» плутония. Нейтронное излучение 5 кг оружейного плутония 300 000 нейт/с создает уровень излучения 0,003 рад/ч на 1 м. Фон снижается отражателем и взрывчатым веществом, окружающим его, в 10 раз. Тем не менее длительный контакт обслуживающего персонала с ядерным взрывным устройством приводит к дозе радиации, равной предельной годовой.
Из-за малой разницы в массах 239Ри и 240Ри эти изотопы не разделяются промышленными способами обогащения. Хотя их можно разделить па электромагнитном сепараторе. Проще, однако, чистый 239Ри получить путем сокращения времени пребывания в реакторе 238U. Нет причин для снижения содержания 240Ри менее 6%, так как эта концентрация не мешает создавать эффективные триггеры термоядерных зарядов.
Помимо оружейного существует и реакторный плутоний. Плутоний из ОЯТ состоит из множества изотопов. Состав зависит от типа реактора и рабочего режима. Типичные значения для реактора на легкой воде: 238Ри — 2%, 239Ри — 61%, 240Ри — 24%,241 Ри — 10%, 242Ри — 3%. Из реакторного плутония бомбу изготовить трудно, но можно.
Некоторые характеристики оружейного и реакторного плутония представлены в табл. 2.7.
Изотопный состав плутония, накапливающегося в реакторе, зависит от степени выгорания топлива. Из пяти основных Некоторые характериетики оружейного и реакторного плутония.
Изотопы плутония. | Период полураспада, лет. | Активность, Ки/г. | Количество оружейного плутония, %. | Количество реакторного плутония, % |
238ри | 87,74. | 17,3. | 1,3. | |
2:i9Pu. | 24 110. | 0,063. | 93,0. | 56,6. |
240Pu. | 0,23. | 6,5. | 23,2. | |
241 Pu. | 14,4. | 0,5. | 13,9. | |
242pu | 379 000. | 0,004. | ; | 4,9. |
образовавшихся изотопов два с нечетными Z — 239Ри и 241Ри являются расщепляющимися, т.с. способными к расщеплению под действием тепловых нейтронов, и могут быть использованы в качестве реакторного топлива.
Если извлеченный из ОЯТ плутоний повторно использовать в реакторах па быстрых нейтронах, его изотопный состав становится менее пригодным для оружейного использования. После нескольких топливных циклов накопление 238Ри, 240Ри и 242Ри делает его неподходящим для этой цели. Подмешивание такого материала — удобный метод «денатурировать» плутоний, гарантируя нераспространение делящихся материалов.
Как оружейный, так и реакторный плутоний содержат некоторое количество 241Ри, который распадается на 241Аш путем излучения р-частицы. Поскольку дочерний 241Аш обладает значительно большим периодом полураспада (432 л), чем материнский 24|Ри (14,4 л), его количество в отработавшем ядерном топливе (ОЯТ) возрастает по мере распада241 Ри. у-Радиация, образующаяся в результате распада 24|Аш, значительно сильнее, чем у241 Ри, следовательно, со временем она также нарастает. Концентрация 24'Ри и период его хранения прямо коррелируют с уровнем у-радиации, образующейся в результате увеличения содержания 241 Ат.
Таким образом, плутоний долго хранить нельзя — после его наработки его надо как можно скорее пустить в дело, иначе его придется снова повергнуть трудоемкому и весьма дорогому рецикл ингу.
Наиболее важный в практическом отношении изотоп 239Ри получают в ядерных реакторах при длительном облучении нейтронами природного или обогащенного урана: 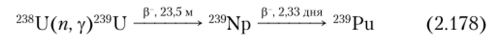
К сожалению, идут и другие ядерные реакции, приводящие к возникновению других изотопов плутония: 238Pu, 240Ри, 241 Ри и 242Ри, отделение которых от 239Ри, хоть и разрешимая, но весьма сложная задача:

Обычно содержание 239Ри в оружейном плутонии составляет 90—95%, 240Ри — 1—7%, содержание других изотопов не превышает десятых долей процента.
При облучении урана реакторными нейтронами в нем образуются как легкие, так и тяжелые изотопы плутония.
Небольшая часть нейтронов, испускаемых в процессе деления, обладает энергией, достаточной для возбуждения реакции 238и (и, 2я)237и. 237U — р-излучатель и с Г½ = 6,8 дня превращается в долгоживущий 237Np. Этот изотоп в графитовом реакторе на природном уране образуется в количестве 0,1% от общего количества одновременно образующегося 239Ри. Захват медленных нейтронов 237Np приводит к образованию 238Np. Поперечное сечение этой реакции 170 барн. Цепочка реакций имеет вид:
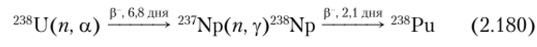
Поскольку здесь участвуют два нейтрона, выход пропорционален квадрату дозы облучения и отношение количеств 238Ри к 239Ри пропорционально отношению 239Ри к 238U. Пропорциональность соблюдается не совсем точно из-за отставания в образовании 237Np, связанного с 6,8-суточным периодом полураспада 237U. Менее важным источником образования 238Ри в 239Ри является распад 242Сш, образующегося в урановых реакторах.
238Ри образуется также по реакциям:
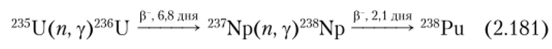
Поскольку это нейтронная реакция третьего порядка, отношение количества 238Ри, образовавшегося таким путем, к 239Ри пропорционально квадрату отношения 239Ри к 238U. Однако эта цепочка реакций становится относительно более существенной при работе с ураном, обогащенным 235U.
Расчеты показывают, что концентрация 238Ри в образце, содержащем 5,6% 240Ри, составляет 0,0115%. Эта величина вносит довольно значительный вклад в суммарную а-активность препаратов, поскольку у 238Ри Г½ = 86,4 л.
Наличие 236Ри в плутонии, получаемом в реакторе, связано с рядом реакций:
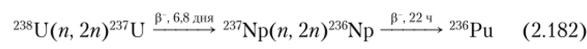
Выход 236Ри в процессе облучения урана составляет ориентировочно 10 9—10″8%.
С точки зрения накопления в уране плутония основные превращения связаны с образованием изотопа 239Ри. Но важны и другие побочные реакции, поскольку ими определяются выход и чистота целевого продукта. Относительное содержание тяжелых изотопов 240Pu, 24lPu, 242Pu, а также 238Ри, 237Np, 241 Am и других трансплутониевых элементов зависит от дозы нейтронного облучения урана (времени пребывания урана в реакторе). Сечения захвата нейтронов изотопами плутония достаточно велики, чтобы вызвать последовательные реакции (п, у) даже при малых концентрациях 239Ри в уране.
Образовавшийся при облучении урана нейтронами 241Ри переходит в 24'Ат, который сбрасывается в процессе переработки урановых блоков (241Ат, однако, снова накапливается в очищенном плутонии). Так, например, a-активность металлического плутония, содержащего 7,5% 240Ри, через год увеличивается на 2% (за счет образования241 Ат).241 Ри обладает большим сечением деления на нейтронах реактора, составляющим 1100 барн, что важно при использовании плутония в качестве реакторного горючего.
Если уран или плутоний подвергнуть сильному нейтронному облучению, то начинается синтез минорных актинидов:
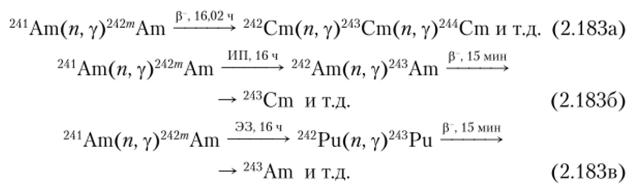
Образовавшийся из 241Pu 241Ат, в свою очередь, вступает в реакции с нейтронами, образуя 238Ри и 242Ри:

Этот процесс открывает возможность получения препаратов плутония с относительно низкой удельной активностью, поскольку выгорает241 Ат — сильный у-излучатель.
Цепочка превращения урана и плутония под действием реакторных нетронов представлена на рис. 2.24.
Таким образом, долгоживущие изотопы плутония — 242Ри и 244Ри образуются при длительном (около 100 дней и более) облучении нейтронами 239Ри. При этом выход 242Ри достигает нескольких десятков процентов, в то время как количество образовавшегося 244Ри составляет доли процента от 242Ри (табл. 2.8). Одновременно получаются Am, Cm и другие трансплутониевые, а также осколочные элементы.
При производстве плутония уран (как правило, в виде металла) облучают в промышленном реакторе, преимущества которого заключаются в высокой плотности нейтронов, невысокой температуре (нет нужды в труднорастворимых оболочках типа циркония) и в возможности облучения в течение заданного времени.
Основная проблема, возникающая при наработке в реакторе оружейного плутония, заключается в выборе оптимального времени облучения урана. Дело в том, что составляющий основную часть естественного урана изотоп 238U захватывает нейтроны, образуя 239Ри, тогда как 235U поддерживает цепную реакцию деления. Поскольку для образования тяжелых изотопов плутония необходим дополнительный захват нейтро;
Таблица 2.8
Изотопный состав плутония, выделенного из облученного нейтронами природного урана.
Количество образовавшегося плутония Pu/кг U, г. | Содержание изотопов в плутонии, вес %. | |||
239ри | 2411 Ри. | 241 ри | 242ри | |
0,5. | 2,9. | 0,14. | ; | |
1,0. | 93,6. | 5,6. | 0,60. | 0,02. |
1,5. | 8,4. | 1,4. | 0,06. | |
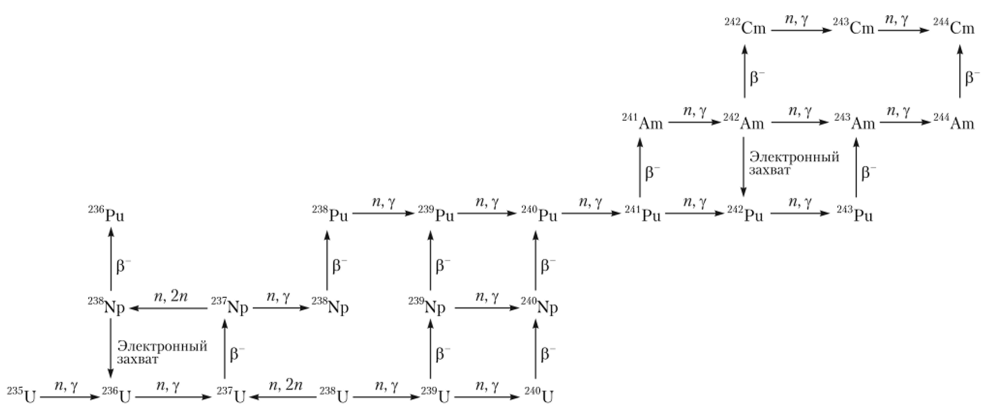
Pwc. 2.24. Некоторые ядра, образующиеся в уране и плутонии при нейтронном облучении нов, то их количество в уране растет медленнее, чем количество 239Ри. Уран, облученный в реакторе короткое время, содержит небольшое количество 239Ри, зато более чистого, чем при длительных выдержках, так как вредные тяжелые изотопы не успевают накопиться. Однако 239Ри сам подвержен делению, и при увеличении его концентрации в реакторе скорость его трансмутации возрастает. Поэтому уран надо извлекать из реактора не позднее, чем через две недели после начала облучения.
Из рис. 2.25 видно, что при увеличении времени облучения урана растет выход 239Ри, но при этом растет и выход 240Ри. В результате чем дольше пребывает плутоний в реакторе, тем больше в нем доля паразитного 240Ри. Поэтому уран находится в промышленном реакторе всего 10 дней, а не 6—8 мес, как в энергетическом реакторе. Плутония получается мало, но зато он — изотопно чистый. Плутоний, производящийся в промышленных реакторах, содержит относительно небольшой процент 240Рп (<7%). Это — оружейный плутоний. ОЯТ реакторов АЭС имеет концентрацию 240Ри более 20%.
Общую меру облученности топливного элемента выражают в МВт-дней/т. Кинетика накопления изотопов плутония в ядерном реакторе представлена на рис. 2.25. Оружейный плутоний получается из элементов с небольшим количеством МВт-дней/т, в нем образуется меньше побочных изотопов. Топливные элементы в современных ВВЭР достигают уровня в 33 000 МВт-дней/т. Типичная экспозиция в бридерном реакторе 1000 МВт-дней/т. Во время Манхеттенского проекта топливо из природного урана получало всего 100 МВт-дней/т, поэтому производился очень высококачественный 239Ри (всего 1% 240Рп, остальные изотопы еще в меньших количествах).
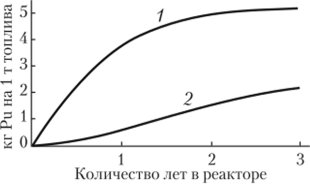
Рис. 2.25. Накопление изотопов плутония в реакторе (изменение изотопного состава от оружейного к реакторному, т.с. к негодному для оружейного использования):
1 — Щ9Ри; 2 — 2тоРи Плутоний — тяжелый серебристо-белый блестящий металл. Радиус атома 0,162 нм, радиус Ван-дер-Ваальса 0,2 нм, энергия ионизации (первый электрон) 491,9 кДж/моль (5,10 эВ), электронная конфигурация [Rn]5/67s2. Радиус иона: (+3е) 0,108 нм, (+4е) 0,086 нм, (5+) 0,074 нм, (6+) 0,071 нм, энергия ионизации (первый электрон) 584,7 кДж/моль, электроотрицательность (по Полингу) 1,28, электродный потенциал Ри Ри4+ -1,25 В, Ри «— Ри3+ -2,0 В, Ри <�— Ри2+ -1,2 В, степени окисления 2,3,4,5,6,7 (основная 4+). Плотность 19,816 (а-фаза), Тпл = 639,4°С, Гкип = 3228 °C, теплота плавления 2,8 кДж/моль, теплота испарения 343,5 кДж/моль, молярная теплоемкость 32,77 ДжДКмоль), молярный объем 12,12 см3/моль. Давление пара плутония значительно выше давления пара урана (при 1540 °C в 300 раз). Плутоний может быть отогнан от расплавленного урана. Температура Дебая 162 К, теплопроводность (27°С) 6,74 ВтДм-К).
Известны шесть аллотропных модификаций металлического плутония. При комнатной температуре существует а-фаза — структура решетки моноклинная, параметры решетки: а = 0,613, b = 0,4822, с = 1,0963, р = 101,8 нм.
В лабораторных условиях металлический плутоний может быть получен по реакциям восстановления галогенидов плутония Li, Са, Ва или Mg при 1200°:
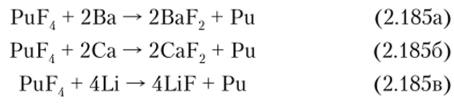
Металлический плутоний получают также при восстановлении в паровой фазе при 1300° трифторида плутония посредством силицида кальция по реакции:

или термическим разложением галогенидов плутония в вакууме.
Химическое поведение плутония имеет большое значение при переработке и очистке плутония для получения чистого металла, при использовании ядерных отходов, при прогнозировании поведения плутония в окружающей среде, при оценке влияния старения на боеспособность ядерного оружия и его безопасность.
Плутоний имеет множество специфических свойств. Он обладает самой низкой теплопроводностью из всех металлов, самой низкой электропроводностью, за исключением марганца. В своей жидкой фазе это самый вязкий металл. При изменении температуры плутоний подвергается самым сильным и неестественным изменениям плотности.
Плутоний обладает шестью различными кристаллическими структурами в твердой форме (табл. 2.9), больше чем любой другой элемент. Некоторые переходы между фазами сопровождаются разительными изменениями объема. В двух из этих фаз — дельта и дельта прим — плутоний обладает уникальным свойством сжиматься при повышении температуры, а в остальных — имеет чрезвычайно большой температурный коэффициент расширения. При расплавлении плутоний сжимается, позволяя нерасплавленному плутонию плавать. В своей максимально плотной форме, a-фазе, плутоний шестой по плотности элемент (тяжелее его только Qs, 1 г, Pt, Re и Np). В a-фазе чистый плутоний хрупок, но существуют его гибкие сплавы. Известно большое число сплавов и интерметаллических соединений Pu с Al, Ga, Be, Со, Fe, Mg, Ni, Ag. Соединение PuBe13 является источником нейтронов с интенсивностью 6,7 • К)7 нейтронов/(с-кг).
Плутоний образует соединения со степенями окисления от +2 до +7. Основная валентность IV. Плутониевые соли легко гидролизируются при контакте с нейтральными или щелочными растворами, создавая нерастворимый гидрооксид плутония. Концентрированные растворы плутония нестабильны из-за радиолитического разложения, ведущего к выпадению осадка. Вследствие своей радиоактивности плутоний теплый на ощупь. Большой кусок плутония в термоизолированной оболочке разогревается до Т> 100 °C.
Мелкоизмельченный плутоний — пироморфен, при 300 °C самовозгорается. Взаимодействует с галогенами и галогеноводородами, образуя галогениды, с водородом — гидриды, с углеродом — карбид, с азотом реагирует при 250 °C с обра;
Таблица 2.9
Плотности и температурный диапазон фаз плутония.
Фаза. | Плотность. | Диапазон существования (°С). |
Альфа. | 19,84 (20°). | Стабильна ниже 122. |
Бета. | 17,8(122°). | 122−206. |
Гамма. | 17,2 (206°). | 224−300. |
Дсльта/дсльта прим. | 15,9 (319°). | 319−476. |
Эпсилон. | 17,0 (476°). | 476—641 (точка плавления). |
Жидкая. | 16,65 (641°). | 641 — до точки кипения. |
зованием нитрида, при действии аммиака также образует нитриды. Взаимодействует с газообразными соединениями серы. Плутоний легко растворяется в соляной, 85%-ной фосфорной, йодистоводородной, хлорной и концентрированной хлоруксусной кислотах. Разбавленная H2S04 растворяет плутоний медленно, а концентрированная H2S04 и HN ()3 его пассивируют и не реагируют с ним. Щелочи па металлический плутоний не действуют.
Это крайне электроотрицательный, химически активный элемент, гораздо в большей степени, чем уран. Он быстро тускнеет, образуя радужную пленку, вначале светло-желтую, со временем переходящую в темно-пурпурную. Если окисление довольно велико, на его поверхности появляется оливково-зеленый порошок оксида (Ри07).
Плутоний легко окисляется, и быстро корродирует даже в присутствии незначительной влажности. При нагревании на воздухе быстро окисляется, а при 300 °C самовозгорается. При нагревании плутония в присутствии водорода, углерода, азота, кислорода, фосфора, мышьяка, фтора, кремния, теллура образует с этими элементами твердые нерастворимые в воде соединения.
Из оксидов плутония известны РиО, Ри903 и Ри02.
Диоксид плутония Ри02 — оливково-зеленый порошок, черные блестящие кристаллы или шарики от красно-коричневого до янтарно-желтого цвета. Кристаллическая структура типа флюорита (Ри4+ формируют ГЦК, а О2 -тетраэдр). Плотность 11,46, Гпл = 2400 °C. Он образуется почти из всех солей (например, оксалата, пероксида) плутония при нагревании на воздухе или в атмосфере 02 при температурах 700—1000°С, независимо от того, в какой степени окисления находится в этих солях плутоний. Например, его можно получить кальцинацией гексагидрата оксалата илутония (1У) Ри (С204)2-6П20 (образуется при переработке ОЯТ) при 600°С:
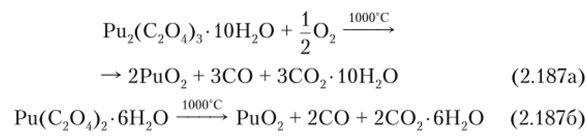
Диоксид плутония, полученный при низких температурах, легко растворяется в концентрированной соляной и азотной кислотах. Напротив, прокаленный РиО., трудно растворим в воде и органических растворителях. Медленно взаимодействует с горячей смесыо концентрированной HN03 с НЕ Это устойчивое соединение применяют в качестве весовой формы при определении плутония. Его используют также для приготовления топлива в ядерной энергетике.
Реакционноспособный Ри02 получают разложением Ри (С204)2-6Н20 при 130—300°С. Он нашел применение в смешанном уран-нлутониевом (МОКС) топливе для ядерных реакторов. Диоксид 238Ри применяется в качестве долговременного источника энергии для космических аппаратов, а также в качестве ядерного заряда мощностью до 1 кт.
Гидрид РиН3 может быть получен из элементов при 150— 200 °C. Плутоний образует галогениды и оксигалогениды, дисилицид PuSi2 и полуторный сульфид PuS133_15, которые представляют интерес ввиду их тугоплавкости.
Плутоний образует карбиды различных стехиометрий: от РиС до Ри2С3. РиС — кристаллы черного цвета, Гпл = 1664 °C. Совместно с карбидом урана может использоваться как UРиС-топливо атомных реакторов.
Нитрид плутония PuN — кристаллы серого (до черного) цвета, имеющие гранецентрирированную кубическую решетку типа NaCl (а = 0,4905 нм, 2 = 4, пространственная группа РтЗт; параметр решетки увеличивается со временем под действием собственного а-излучеиия); Тпл = 2589 °C (с разложением); плотность 14,35 г/см3. Обладает высокой теплопроводностью. При высокой температуре (порядка 1600°С) летуч (с разложением). Получается при взаимодействии плутония с азотом при 600 °C или со смесью водорода с аммиаком. Порошкообразный PuN окисляется на воздухе при комнатной температуре, полностью превращаясь в Ри02 через 3 сут, медленно гидролизуется холодной водой и быстро — при нагревании, образуя Ри02; легко растворяется в разбавленных НС1 и H2S04 с образованием соответствующих солей Pu (III); по силе действия на нитрид плутония кислоты могут быть расположены в ряд HN03 > НС1 > Н3Р04 H2S04 > НЕ.
PuN используется как реакторное топливо.
Существует несколько фторидов плутония: PuF3, PuF4, PuF6.
Тетрафторид плутония PuF4 — вещество розового цвета или коричневые кристаллы моноклинной сингонии. Изоморфен с тетрафторидом Zr, Hf, Th, U, Np и Се. Тпл = 1037 °C, Ткш = 1277 °C. Он плохо растворим в воде и органических растворителях, но легко растворяется в водных растворах в присутствии солей Ce (IV), Fe (III), А1(Ш) или ионов, образующих с ионами фтора устойчивые комплексы. Розовый осадок PuF4-2,5H20 может быть получен осаждением плавиковой кислоты из водных растворов солей Pu (III). Это соединения дегидратируется при нагревании до 350 °C в токе НЕ.
PuF4 образуется при действии HF на Ри02 в присутствии кислорода при 550 °C по реакции:
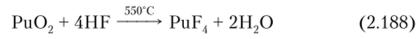
PuF4 можно также получить обработкой PuF;i фтором при 300 °C или нагревом солей Pu (III) или Pu (IV) и в токе НЕ Из водных растворов Pu (IV)PuF4 осаждается плавиковой кислотой в виде розового осадка состава 2PuF4 • Н20. При нагревании на воздухе до 400 °C PuF4 превращается в Ри02.
Гексафторид плутония PuF6 — летучие кристаллы при комнатной температуре желтовато-коричневого цвета (при низких температурах — бесцветные) ромбической структуры, Тпч = 52 °C, Ткип = 62 °C при атмосферном давлении, плотность 5,06 г/см3, весьма склонен к коррозии и чувствителен к авторадиолизу. PuF6 — легкокипящая жидкость, термически значительно менее стабильная и менее летучая, чем UF6. Пары PuF6 окрашены подобно N0., жидкость имеет темнокоричневый цвет. Сильный фторирующий агент и окислитель; бурно реагирует с водой. Крайне чувствителен к влаге; с Н20 при дневном свете может реагировать очень энергично с образованием Ри02 и PuF4. PuF6, сконденсированный при -195°С на лед, при нагревании медленно гидролизуется до Pu02F2. Компактный PuF6 самопроизвольно разлагается вследствие a-излучения плутония.
Гексафторид плутония получают обработкой PuF4 или Ри02 фтором при 700 °C.

Фторирование PuF4 фтором при 700 °C происходит очень быстро и является экзотермической реакцией. Образующийся PuF6 во избежание разложения быстро удаляют из горячей зоны — вымораживают или проводят синтез в потоке фтора, который достаточно быстро выводит продукт из реакционного объема.
PuF6 можно также получить, но реакциям: 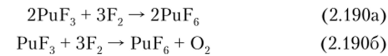
Существуют нитраты Pu (III), Pu (IV) и Pu (VII): Pu (N03)3, Pu (N03)4 и Pu02(N03)2 соответственно.
Нитрат плутония Pu (N03)4-5H20 получают медленным испарением концентрированного азотнокислого раствора Pu (IV) при комнатной температуре. Кристаллизацию соли можно несколько ускорить, пропуская поток воздуха через раствор или внося затравку кристаллического Pu (N03)4 • 5Н20. При быстром испарении образуется плохо закристаллизованная масса, похожая на резину. Кристаллизуется в виде черных призм с зеленоватым оттенком и слабовыраженным дихроизмом. Кристаллическая структура ромбическая. Устойчив при комнатной температуре, при 95—100°С плавится в собственной кристаллизационной воде с разложением, при 150— 180 °C образует нитрат плутонила Pu02(N03)2. Хорошо растворим в HN03 и воде (азотнокислый раствор темно-зеленого или коричневого цвета). Растворяется в ацетоне, эфире и ТБФ. Растворы нитрата плутония и нитратов щелочных металлов в концентрированной HN03 при упаривании выделяют двойные нитраты Me2[Pu (N03)6], где Ме+ = = Cs+, Rb+, К Th+, C9H7NH+, C5H5NH+, NH4+.
Известны оксалаты Pu (III), Pu (IV) и Pu (VI). Все они получаются при действии щавелевой кислоты на кислые растворы плутония соответствующей валентности.
Оксалат плутония (ГУ) Ри (С204)2*6Н20 — порошок песочного (иногда желто-зеленого) цвета. Изоморфен с U (C904) X х 6Н20. В зависимости от условий осаждения может существовать в виде игольчатых кристаллов или четырехугольных пластинок. При хранении на воздухе теряет три молекулы воды и переходит в форму Ри (С204)2-ЗН20. Гексагидрат оксалата плутония плохо растворим в минеральных кислотах и очень хорошо в растворах оксалатов и карбонатах аммония или щелочных металлов с образованием комплексных соединений. Склонен к авторадиолизу. Осаждается щавелевой кислотой из азотнокислых (1,5—4,5 М HN03) растворов Pu (IV) по реакции:

Обезвоживается при нагревании на воздухе до 110°, выше 400° разлагается:
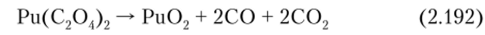
В соединениях плутоний проявляет степени окисления от +2 до +7. В водных растворах образует ионы, отвечающие степеням окисления от +3 до +7. При этом ионы всех степеней окисления, кроме Ри7 могут находиться в растворе одновременно в равновесии. Ионы плутония в растворе подвергаются гидролизу и легко образуют комплексные соединения. Способность образовывать комплексные соединения увеличивается в ряду:
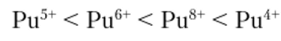
Вследствие электроположительной природы атом плутония в водном растворе легко теряет от трех до семи внешних электронов с образованием положительно заряженных катионов в пяти формальных состояниях окисления — Pu (III), Pu (IV), Pu (V), Pu (VI) и Pu (VII). Ион данного металла в каждом из состояний окисления способен образовывать много молекулярных комплексов, каждый из которых имеет свою характерную растворимость и химическую активность. Плутоний — единственный элемент в периодической системе элементов, который может иметь в водных кислых растворах одновременно четыре различных состояния окисления.
В кислой среде, такой как хлорная кислота, в которой не образуются комплексы, Pu (III) и Pu (IV) существуют в форме простых гидратных ионов (акваионов). Молекулы воды располагаются вокруг иона металла, образуя молекулярные катионы Ри (Н20)^+ и Pu (H20)//j+, где п может меняться в зависимости от концентрации других ионов (или ионной силы). Обычно значения п равны 8, 9 и 10. Акваионы с восемью лигандами представлены в верхней части рис. 2.26, а структура с девятью лигандами — на рис. 2.26, г.
Pu (V) и Pu (VI) имеют настолько большие положительные заряды, что в водном растворе они легко притягивают атомы кислорода из молекул воды и образуют уникальный класс катионов — транс-диоксо-катионы Ри02 или Ри02+. Атом плутония располагается между двумя атомами кислорода в линейной структуре 0=Ри=0, известной как плутонил, а все лиганды связываются в экваториальной плоскости этой структуры. У акваионов Ри02(Н20)~ и Ри02(Н20)^+, содержащих Pu (V) и Pu (VI), обычно имеется пять молекул воды в экваториальной плоскости (рис. 26, д). Тетрагональная бипирамида Pu (VII) (рис. 2.26, е) может образоваться лишь в экстремальных условиях окисления.
Химическое поведение плутония в растворе зависит от его окислительного состояния. Например, соединения Ри (Ш) и Pu (IV) малорастворимы, a Pu (V) и Pu (VI) — растворимы.
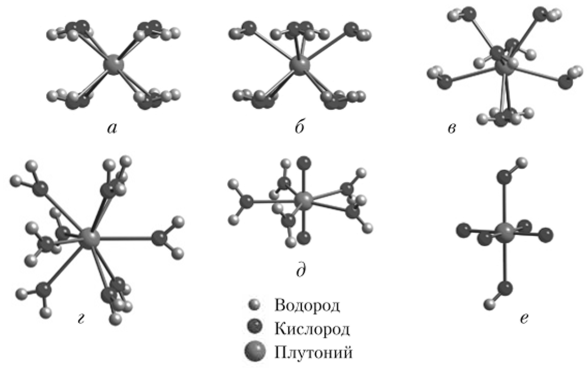
Рис. 2.26. Геометрические структуры молекул акваионов плутония:
a — Pu (III, IV): куб; б — Pu (III, IV): квадратная антипризма; в — Pu (III, IV): двенадцатигранник; г — Pu (III, IV): тригональная призма с тремя шапками; д — Pu (V, VI): пентагональная бипирамида; е — Pu (VII): тетрагональная пирамида.
Pu (IV) гидролизуется с образованием легких зеленых золей или твердых коллоидов. Эти коллоиды стареют, и их растворимость со временем уменьшается. Такие коллоиды могут прилипать к коллоидам на основе природных минералов, что важно для миграции плутония в естественной окружающей среде. Способность к гидролизу Pu (V) является наименьшей из всех окислительных состояний. При следовых концентрациях в близких к нейтральным растворах Pu (V) является достаточно устойчивым, с преобладающим состоянием окисления в таких природных средах, как морская вода и грунтовые воды.
Степеням окисления Pu (III, IV, V и VI) соответствуют следующие ионные состояния в кислых растворах: Pu3+, Ри4+, РиС>2+ и PuOij-. Ввиду близости потенциалов окисления ионов плутония друг к другу в растворах могут одновременно существовать в равновесии ионы плутония с разными степенями окисления (единственный подобный случай в химии). Кроме того, имеет место диспропорционирование Pu (IV) и Pu (V) по схемам: 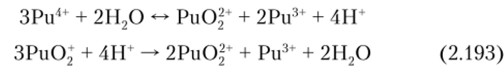
Скорость диспропорционирования растет с увеличением концентрации плутония и температуры.
По своим свойствам Pu (III) близок к РЗЭ. Ион Pu (III) может быть получен растворением тригалогенидов в воде, путем восстановления растворов Pu (IV) насыщенной водородом платиновой чернью, гидрохиноном, гидразином или восстановлением Ph (VI) при 90 °C в 5%-ном HN03 сернистым газом, гидроксиламином или металлическим цинком. Растворы Ри3+ медленно окисляются кислородом даже при повышенных температурах и имеют сине-фиолетовую окраску.
Ри (Ш) склонен к гидролизу:
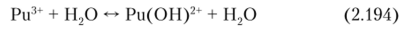
При действии на Ри3+ щелочей выпадает основной гидроксид Ри (0Н)3хН20. При действии соответствующих реагентов из растворов Ри3+ выпадают в осадок его малорастворимые соли Pu (I03)3, РиР04? 0,5Н2О, Pu2(C204)3 H20, Pu[Fe (CN)6] • Н20.
Плутоний (ГУ) является наиболее устойчивым состоянием плутония в водных растворах. Ион Pu (IV) в водном растворе на воздухе устойчив, но диспропорционирует на Pu (IV) и Pu (VI):
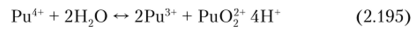
Скорость реакции диспропорционирования и константа равновесия резко возрастают с увеличением температуры.
Ион Pu (IV) может быть получен окислением Ри3+ или восстановлением плутония в высших степенях окисления гидроксиламином, муравьиной или щавелевой кислотой.
Рц4+ гидролизуется гораздо сильнее, чем Ри3 В растворе с pH > 1 идет реакция:
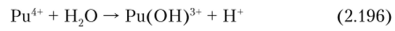
Гидролиз Ри4+ не заканчивается образованием Ри (ОН)3+, а продолжается далее и приводит к образованию крупных коллоидных частиц и в конечном итоге к образованию труднорастворимого осадка Ри (ОН)4. Осаждение гидроксида происходит уже при pH 2, он склонен к полимеризации. Ион Pu (IV) в кислых растворах гидратирован.
Pu (IV) склонен к комплексообразованию, в частности с азотной, серной, соляной, уксусной и другими кислотами. Так, в концентрированной азотной кислоте Pu (IV) образует комплексы Pu (N03)5~ и Pu (N03)g. Фторид, гидрооксид, оксалат, йодат Pu (IV) труднорастворимы в воде. Микроколичества Pu (IV) хорошо соосаждаюгся с нерастворимым гидрооксидом, фторидом лантана, иодатами Zr, Th, Се, фосфатами Zr и Bi, оксалатами Th, U (IV), Bi, La Хорошо растворимыми соединениями являются Pu (S04)2-4H20 и Pu (N03)4-8H20. Pu (IV) образуют двойные фториды и сульфаты с Na, К, Rb, Cs и NH4. Pu (V) может быть получен в 0,2 М растворе HN03 при смешении растворов Pu (III) и Pu (VI). Из солей Pu (VI) интерес представляют натрийплутонилацетат NaPu02(C2H302)3 и аммонийнлутонилацетат NH4Pu02(C2H302).
Ион Pu (V) Pu02 — плутоноил-ион — в растворе получается восстановлением Pu (VI) йодидом натрия или сернистым газом при pH 2, а также электрохимическим восстановлением Pu (VI).
В слабокислых растворах Pu (V) медленно диспропорционирует по схеме: 
что вызвано близостью потенциалов пар Pu (VI)/(V), Pu (V)/(IV) и Pu (IV)/(III).
В равновесии находятся все четыре вида ионов плутония. Равновесие сильно зависит от кислотности раствора: чем крепче кислота, тем меньше содержание Pu (V). Комплексообразующие кислоты сильно ускоряют диспропорционирование. Ион Ри02 образует нерастворимые соли КРи02С03 и NH4Pu02C03. Плутоноил-ион гидролизован мало. При pH «3,6 в осадок выпадает амфотерный гидроксид Ри02(0Н), которому соответствуют соли состава Me9Pu9CL — плутониты (Me—NH4, Na).
Присутствие комплексующих лигандов увеличивает потенциал пары Pu (V)/(IV), снижает потенциалы пар Pu (VI)/(V) и Pu (IV)/(III), что приводит к сдвигу равновесия (2.197а) вправо и уменьшению роли реакции (2.1976). В водно-органических растворах положение равновесия (2.197а) зависит от содержания Н20, наличия Н гидролиза ионов, комплексообразования с анионами. При диспропорционировании Pu (V) в оксалатных средах реакция (2.1876) не протекает, так как Pu (IV) образует прочные комплексы с анионами С204 .
В водных средах, содержащих комплексующие лиганды и имеющие значения pH в диапазоне 3—5, Pu (V) является кинетически устойчивым, т. е. может существовать в раствоpax определенного состава достаточно долго для формирования твердой фазы. Примерами комплексов плутоноила являются фталатные соединения:
- • [Co (NH3)6][Pu02L2] *2Н20, где L = С6Н4(ООС)2
- • биоксалатные Co (NH3)6Pu02(C204)2 nH20
- • мономалонатные Co (NH3)6[Pu02L]2C104 «H20, Co (NH3)6[Pu02L]2C1 • яН20, Co (NH3)6[Pu02L]2N03 • пН20 и Co (NH3)6[Pu02L]OOCH -3H20, где L = С3Н204
- • двойные малонаты MPu02(00C)2CH2 wH20, М = Na, NH4, Cs
- • монооксалатные NaPu ()2C.;04-3H20
- • бисульфатные Co (NH3)6Pu02(S04)2-2H20
- • триацетатные CsPu02Ace3
- • двойные ацетаты BaPu02Ace3H20 и SrPuAn02Ace3-3H20, где Асе = СН3СОО
- • смешаннолигандные C10H8N2PuO2(6/p"/)OOCH wH2O, где Ыру = 2,2'-биниридин и др.
Ион Pu (VI) Pu02+ получается жестким окислением плутония низших степеней, окислением горячей азотной кислотой, горячим раствором бихромата или перманганата калия, персульфатом аммония, Се4+, NaBiOs и другими Ри02+. В водных растворах устойчив. При pH «5 начинается гидролиз плутонил-иона, а при pH 6—9 идет образование гидроксида плутонила Ри02(0Н)2, который амфотерен. Pu (VI) образует соли плутонила, плутонаты и полиплутонаты. Хорошо растворимы плутонилнитрат Pu0.;(N03)9, плутонилхлорид Ри02С12 и перхлорат плутония Ри02(СЮ4)2, плохо растворимы плутонилфторид Pu02F2, плутонилтриацетат натрия NaPuOXCH3CO.;)3, плутонилйодат Ри09(Ю3)2. При действии на растворы Pu (VI) щелочей или аммиака образуются соли плутониевых кислот — плутонаты и полиплутонаты: Na2Pu, 07^ (NH4)Pu207, BaPu308.
Ион Pu (VII) Pu03_ получается действием сильных окислителей (озона, персульфата калия, и др.) в щелочных растворах на Pu (VI). Ион малоустойчив даже в щелочной среде и восстанавливается водой до Pu (VI). Из раствора осаждается в виде солей Ва3(Ри05)2 ггН20, Sr3(Pu05)2-^H20. Примерами солей щелочных металлов с трехзарядными анионами Pu (VII) являются Na3[Pu04(0H)2]-2H20, K3[Pu04(0H)2]-2H20 и Cs3[Pu04(OH)2] -ЗН20.
Уникальность плутония по сравнению с другими элементами заключается в том, что у него окислительно-восстановительные потенциалы, соответствующие четырем основным состояниям окисления в кислом растворе (III, IV, V, VI), очень близки между собой (около 1 В). Поэтому катионы плутония легко вступают в реакцию с ионами своего сорта посредством реакции диспропорционирования, при которой два взаимодействующих иона в одном и том же состоянии окисления одновременно окисляются и восстанавливаются с образованием более высокого и более низкого состояния (рис. 2.27). И наоборот, при некоторых условиях два иона плутония разных состояний окисления могут вступать в реакцию репропорционирования, в результате чего два иона одновременно окисляются и восстанавливаются с образованием двух ионов одного и того же состояния окисления.
Уравнения окислительно-восстановительных реакций акваинов в кислой среде:

1 мг 239Ри испускает примерно 1 Ю6 а-част/с, поэтому при радиолизе воды образуются довольно сильные окислительно-восстановительные агенты, в том числе короткоживущие радикалы Н*, ОН* и О*, а также продукты рекомбинации радикалов, как Н2, 02 и Н202. В результате радиолиз способствует восстановлению Pu (VI) и Pu (V) до состояний Pu (IV) и Pu (III). Реакции, при которых происходит образование и разрыв связей Ри=0 в транс-диоксо-катионах Pu (V) и Pu (VI) являются кинетически медленными процессами. Поэтому четыре состояния окисления (с III по VI) могут сосуществовать в достаточно больших концентрациях в одном и том же растворе при определенных химических условиях.
Прочность комплексообразования зависит от конкурентноспособности лиганда в борьбе с водой за координационную оболочку акваиона. При создании внутрисферных комплексов происходит замещение молекул воды комплексующими.

Рис. 2.27. Разность между окислительными потенциалами акваионов плутония в 1 М растворе НСЮ^.
лигандами. Как лиганд, так и остающиеся молекулы воды связываются непосредственно с центральным атомом металла. При таких видах взаимодействий могут образовываться очень устойчивые комплексы. Более слабые комплексы образуются, если лиганд связывается с центральным атомом металла водой (внешнесферные комплексы).
Ионы плутония (рис. 2.28) образуют прочные внутрисферные комплексы с лигандами, содержащими атомы-доноры кислорода, с фторидами, хлоридами и т. д., а также с оксоаниопами (СО3″, NO3, РО3- и т. д.), многие из которых имеются в природных водах. Кроме того, ионы плутония образуют комплексы средней прочности с донорами азота и слабые внешнесферные комплексы с лигандами-донорами серы. Они также обнаруживают особую устойчивость в случае хелатных лигандов с атомами-донорами кислорода и азота.
Сравнительная способность плутония к образованию комплексов зависит от отношения его заряда к ионному радиусу. Поскольку ионные радиусы четырех наиболее распространенных состояний окисления близки по величине, устойчивость комплекса зависит от полного заряда центрального иона плутония или алкил-иона: Pu4+ > Pu3+ ~ РиО^ > РиО^.
Ри1+ образует самые прочные комплексы, а РиО^ — самые слабые.
Ионы плутония имеют относительно большие ионные радиусы, и к ним могут присоединяться различные лиганды, поэтому многие атомы-доноры образуют связи с центральным ионом плутония, и в комплексах плутония распространены координационные числа 8 и 9. Способность анионов к комплексообразованию с ионами плутония убывает для однозарядных анионов — фторид > нитрат > хлорид > перхлорат; для двухзарядных анионов — карбонат > оксалат > сульфат. Система карбоната плутонила (VI) может быть достаточно сложной, так как она состоит из нескольких раз;
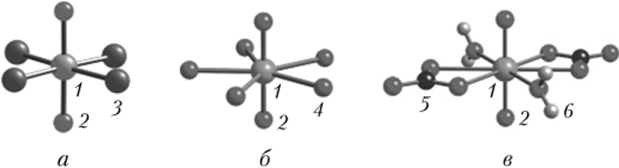
Рис. 2.28. Структуры некоторых комплексов Pu (V) и Pu (VI):
а — Pu02ClJ_; б — Pu02F|"; в — Pu2(N03)2(H20)2;
/ - Pu; 2 — Q 3 — Cl; 4 — F; 5 — N; 6 — H личных комплексных ионов в состоянии равновесия друг с другом и с акваионом или с гидролизованными формами в зависимости от условий в растворе. Идентифицированы такие комплексы, как Pu02(C03), Ри02(С03)2 Ри02(С03)3. Образование комплекса Pu (VI) с карбонатом стабилизирует Pu (VI) относительно окислительно-восстановительного диспропорционирования.
Карбонат и бикарбонат исключительно сильные комплексообразующие агенты для плутония. Ионы, которые обычно довольно плохо растворяются в почти нейтральных растворах, могут образовывать комплексы с карбонатными лигантами и за счет образования анионных комплексов стать намного более растворимыми. Именно поэтому карбонатные комплексы играют важную роль в миграции ионов плутония из хранилища ядерных отходов или при аварийном загрязнении объекта.
Большое число комплексных ионов образуется с органическими веществами. Примером является Pu (r|-C8H8)2, соединение Pu (IV) в виде сэндвича — плутоцена (рис. 2.29). В нем циклооктатетраенильные кольца (ЦОТ-кольца) расположены в эклиптической конфигурации. Идентифицированы комплексы лиганда циклопентадиенила (г|-С5Н5), сокращенно — Цп. Лиганды ЦОТ и Цп занимают три координационные позиции металлического центра Pu (IV): Pu®-CSH8)2, Pu (r|-C5H5)3C1 и Pu (r|-C5H5)4, имеют координационные числа соответственно 6, 10 и 12. Pu (VI) с тиофен-2-карбоновой кислотой образует анионный комплекс [Pu02(00CC4H3S] .
Комплексы как Pu (IV), так и Pu (VI) способны хорошо экстрагироваться из кислых растворов такими растворителями, как этиловый эфир, ТБФ, диизопропилкетон и др. Неполярными органическими растворителями хорошо экстрагируются клешневидные комплексы, например с а-тено;

Рис. 2.29. Некоторые органические комплексы плутония:
а — Pu (r|-C8H8)2; 6— Pu (r|-C5H5)3C1; в — Pu (ri-C5H5)4
илтрифтор-ацетоном, р-дикетоном, купфероном. Экстракция комплексов Pu (IV) с а-теноилтрифторацетоном (ТТА) позволяет провести очистку плутония от большинства примесей, включая актиниды и РЗЭ.
Каждое состояние окисления плутония имеет характерный цвет в растворе, и в спектре поглощения электронов обнаруживаются характерные для него спектральные особенности.
Водные растворы ионов плутония в разных состояниях имеют следующие цвета: Pu (III), как Ри3+, — голубой бледнолиловый; Pu (IV), как Ри4+, — желто-коричневый; Pu (VI), как PuOf+, — розово-оранжевый. Цвет Pu (V), как РиО.}, — первоначально розовый, но будучи нестабильным в растворе, этот ион диспропорционирует в Ри4+ и РиО^. Ри4+ затем окисляется, переходя из Р11О2 в РиО^, и восстанавливается в Ри3+. Таким образом, водный раствор плутония со временем представляет собой смесь Ри3+ и РиО|+. Спектры поглощения акваионов плутония в различных степенях окисления представлены на рис. 2.30.
Pu (VII), как PuOf (темно-красный) ион, является редким и существует только в чрезвычайно окислительных условиях.
Цвет раствора с плутонием зависит как от его валентности, так и от природы аниона, причем существенное влияние оказывает способность плутония образовывать комплексы с кислотным анионом.
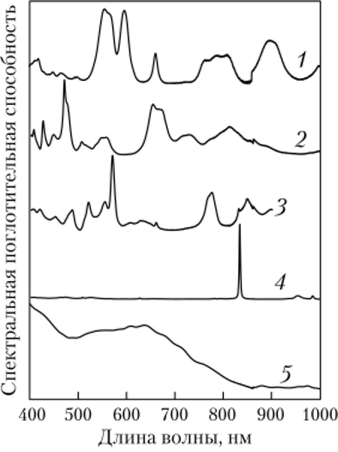
Рис. 2.30. Электронные спектры поглощения акваионов плутония:
1 — Pu (III); 2 — Pu (IV); 3 — Pu (V); 4 — Pu (VI); 5 — Pu (VII).
Для обнаружения плутония используют радиометрический метод, основанный на измерении общего а-излучения плутония и его энергии. Этот метод не требует проведения сложных химических операций и больших затрат. Он позволяет обнаружить 0,0001 мкг 239Ри. При наличии в анализируемом образце других а-излучателей идентификация плутония может быть выполнена измерением энергии а-частиц при помощи а-анализаторов.
Для качественного определения плутония используется различие в свойствах валентных форм плутония. Ион Ри (Ш) в довольно концентрированных водных растворах можно обнаружить по ярко-голубой окраске, резко отличающейся от желто-коричневой окраски водных растворов, содержащих ионы Pu (IV).
Спектры светопоглощения растворов солей плутония в различных степенях окисления имеют специфические и узкие полосы поглощения, что позволяет проводить идентификацию валентных форм и обнаружение одной из них в присутствии других. Наиболее характерные максимумы светопоглощения Pu (III) лежат в области 600 и 900 ммк, Pu (IV) — 480 и 660 ммк, Pu (V) — 569 ммк и Pu (VI) 830−835 ммк.
Для обнаружения плутония могут быть использованы реакции с интенсивными окрашенными реагентами типа арсеназо и «ТОРОН».
Изотоп 236Ри применяют для изучения метаболизма плутония в организме и в радиоэкологических исследованиях, 237Ри — в системах контроля химического выхода плутония в процессе его выделения из проб окружающей среды, 238Ри — в малогабаритных радиоизотопных источниках энергии и нейтронных источниках, в составе радиоизотопных дымовых детекторов. 239Ри используется как топливо в ядерных реакторах на тепловых и быстрых нейтронах, как рабочее вещество ядерного заряда (критическая масса для гладкого шара из металлического 239Ри составляет около 10 кг, для шара в водяном отражателе — порядка 5,2 кг), а также в качестве исходного вещества для получения трансплутониевых элементов.
Производство металлического плутония и изделий из него — сложный процесс.
После переработки ОЯТ в результате экстракции органическими растворителями получается разбавленный раствор нитрата плутония в азотной кислоте. Чтобы избежать больших потерь при осаждении, исходный раствор, полученный путем экстракции, концентрируют до содержания плутония 10—100 г/л. Это достигается выпариванием, экстракцией растворителями или методами ионного обмена. Далее из концентрата можно получить металлический плутоний, осаждая подходящее соединение, например PuF3, который затем восстанавливается до металла, оксалата плутония или пероксида плутония. Эти соединения перед восстановлением переводятся сухим методом в PuF4. Выбор процесса зависит от степени чистоты исходного раствора, легкости извлечения из него плутония, коэффициентов очистки и от применяемого оборудования.
Металлический плутоний может быть получен пирохимическим восстановлением любого галогенида плутония подходящим щелочным или щелочноземельным металлом. Часто PuF4 восстанавливают кальцием и иодом. Высокую очистку достигают электролитическим рафинированием пирохимически произведенного металла. Это делается в ячейках для электролиза при 700 °C с электролитом из натрия, калия и хлорида плутония, вольфрамовым или танталовым катодом. Таким образом получают 99,99%-ный плутоний. Другие способы базируются на прямом пирохимическом восстановлении и электрорафинировании оксида плутония. Преимущество этих методов — меньшее количество отходов производства. Обработка расплавленного плутония и литье плутония осуществляются на оборудовании, сделанном из слегка окисленного тантала. Литейные формы могут изготавливаться из графита, мягкой стали или чугуна, если они покрыты фторидом кальция или оксидом циркония или иттрия.
Лучшей реакцией является восстановление тетрафторида PuF4 кальцием:
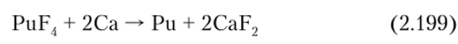
Восстановление PuF4 проводят при нагревании в индукционной печи или в печи сопротивления реактора, выложенного огнеупорным материалом и выдерживающего давление 28 атм. при Г~ 1600 °C. Выход 99%, степень чистоты 99,87 вес.%.
К металлическому плутонию предъявляются высокие требования по чистоте в отношении элементов, изотопы которых обладают большим сечением захвата нейтронов. Некоторые из них (Nd, Sm, Eu, Gd, Ru) являются продуктами деления. Полученный из галогенидов металлический плутоний содержит 1% примесей. Для очистки его сплавляют с ZnCl2 (примеси переходят в образующийся цинк), затем соль отделяют от металлического цинка и восстанавливают кальцием. Отделение плутония от цинка и кальция проводят дистилляцией. Одним из приемов дополнительной очистки является метод зонной плавки. Существуют методы получения чистого плутония электролизом расплавов хлоридов.
Во всех описанных выше методах получается порошкообразный металл, из которого плавлением изготавливают слитки.
На рис. 2.31 показаны пять из шести кристаллических структур плутония, начиная с а-Pu и следуя по часовой стрелке до 8-Ри в порядке, в котором они возникают по мере нагрева металла. Шестая структура 8' (которая расположена между 8- и s-фазой) не показана, поскольку 8 и 8' выглядят почти одинаково.
Как уже упоминалось, при разных температурах металлический плутоний существует в шести кристаллических модификациях (см. рис. 2.31). Седьмая структура возникает при высоких давлениях. При комнатной температуре плутоний имеет моноклинную кристаллическую структуру (а-фаза, 16 атомов в элементарной ячейке), в которой плутоний имеет свою максимальную плотность — 19,84 при 20 °C. Атомы в a-фазе связаны ковалентной связью, поэтому физические свойства ближе к минералам, чем к металлам. Это твердый, хрупкий и ломающийся в определенном направлении материал. a-фаза не поддается обработке обычными для металлов технологиями; р-фаза — это ОЦК моноклинная решетка с 34 атомами в элементарной ячейке; 8-фаза — объемно центрированная кубическая ячейка с 2 атомами в элементарной ячейке; у-фаза — объемно центрированная орторомбическая решетка с 8 атомами в элементарной ячейке; 8-фаза представляет собой гранецентрированную кубическую решетку с 4 атомами в элементарной ячейке. В 8-фазе (плотность 15,9 г/см3) плутоний достаточно ковкий и вязкий. Таким он бывает и в у-фазе. В 8-фазе плутоний имеет нормальные метал;
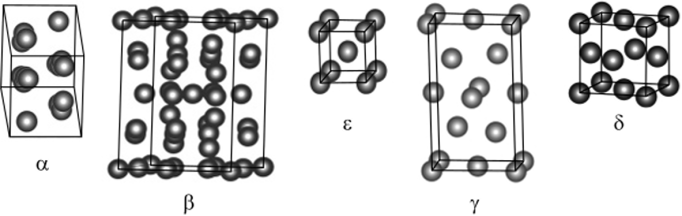
Рис. 231. Кристаллические структуры металлического плутония.
лические свойства, включая превосходную ковкость. 5-Фаза имеет прочность и пластичность, сходную с алюминием, делая простой обработку и отливку.
Хотя 5-фаза и проявляет аномальное свойство сжиматься при нагревании, этот отрицательный коэффициент расширения невелик. Плутоний в 5-фазе неустойчив — стремится осесть в плотную a-фазу под очень небольшим давлением, увеличив на 25% свою плотность. Увеличение на 25% плотности урана (или а-Ри) требует давления 450 килобар. При давлениях свыше 30 килобар плутоний существует только в аи p-фазах. Это свойство перехода дельта (5) —3? альфа (а) фазы (и увеличение его плотности на 25%) используется в имплозионных схемах оружия.
Плутоний можно стабилизировать в 5-фазе при комнатной температуре путем сплавления его с Ga, Al, Ze, In и Am в концентрации нескольких молярных процентов. Даже стабилизированная 5-фаза продолжает оставаться легко сжимаемой давлением в несколько килобар.
Нелегированный плутоний и сплавы Pu-Ga расширяются с образованием ОЦК г-фазы, которая также расширяется, когда превращается в 5-фазу. Однако при охлаждении плутониевые сплавы не испытывают огромной усадки, как нелегированный плутоний. По мере охлаждения до комнатной температуры они лишь слегка сжимаются, поскольку остаются в 5-фазе, не испытывая превращения в у-, ри a-фазы. С увеличением содержания галлия в сплаве незначительно повышаются температуры плавления и 5—s-фазовых превращений.
Для оружейного применения плутоний стабилизируется в 5-фазе сплавлением с 3 мол.% (0,9% по весу) Ga. Этот сплав стабилен при температурах от -75 до +475°С. Стабилизация предотвращает изменения объема плутония при колебаниях температуры после получения, что может повредить прецизионно-изготовленные компоненты устройства. Сплав имеет почти нулевой коэффициент теплового расширения (рис. 2.32). Литье его облегчено из-за наличия единственного эпсилон (s) —* —? дельта (5) фазового перехода во время охлаждения. Наконец, стабилизация снижает восприимчивость плутония к коррозии. Недостаток галлия — трудность его отделения от плутония при переработке оружейных компонентов в реакторное топливо.
Плавка и отливка плутония осложняются высокой реакционной способностью расплавленного металла. Обычно тигли для расплавленного плутония, нагреваемого при тем;
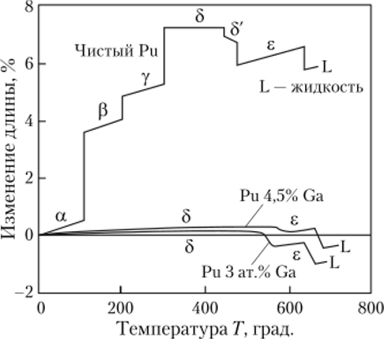
Рис. 232. Фазовые переходы в плутонии и в сплавах плутония.
с галлием пературах не выше 1200 °C, изготавливают из оксидов магния или кальция. Для более высоких температур (выше 1500°) используются тигли из диоксида тория.
Поскольку плутоний химически реактивен, то изделия из него покрывают тонким слоем инертного металла (серебро, никель, золото), который также уменьшает токсичность плутония.
Плутоний идет на изготовление питов (рис. 2.33) — недемонтируемых таблеток для ядерного заряда, герметично запакованных в оболочку из тугоплавкого металла. Из этих пи;
%/ %/
тов и изготавливается ядерный заряд. В некоторых видах оружия пит состоит из 235U и плутония (обогащение по 239Ри более 90%).
Плутониевые и урановые питы подвержены сильной химической и радиационной коррозии. Во влажном воздухе коррозия питов усиливается в 200 раз. Благодаря каталитическому эффекту водород увеличивает скорость коррозии.

Рис. 233. Отливка из плутониево-галлиевого сплава (плутониевый пит) — компонент ядерного заряда.
в 13 раз. Водород возникает при взаимодействии влаги с металлом или с окружающими пит органическими материалами (например, пластмассами). Окисление увеличивает объем плутония и приводит к деформации пита или к разрыву контейнера, в котором он хранится. Загрязнение пита дейтерием или тритием (другие компоненты заряда) вызывает коррозию, сопровождающуюся появлением на поверхности пита пирофорного гидрида плутония, который сильно ускоряет коррозию атмосферным кислородом. Радиоактивный распад плутония вызывает нагрев пита, поэтому его необходимо постоянно охлаждать. Все эти факторы создают проблемы при хранении питов.
Хотя плутоний, как и любой тяжелый металл, химически токсичен, этот эффект выражен слабо по сравнению с его радиотоксичностью. Токсические свойства плутония появляются как следствие а-распада. Важно, что плутоний весьма летуч. Стоит пронести открытый его образец через комнату, как допустимое содержание плутония в воздухе будет превышено. Кроме того, он очень склонен к образованию аэрозолей. Поэтому в процессе дыхания он легко проникает в легкие и бронхи, затем — в кровь, после чего откладывается в различных органах в количестве, зависящем от растворимости его соединений. Плутоний очень плохо всасывается желудочно-кишечным трактом, даже когда попадает в него в виде растворимой соли (порядка 0,05%). Через кожу он практически не проникает.
Плутоний накапливается в основном в печени и скелете, где остается в течение продолжительного времени (ТС) ~ 30 и 50 л соответственно). Чем старше человек, тем больше плутония накапливается в его печени. В скелете плутоний постепенно распределяется, но всему объему костей. По своей биологической активности изотопы плутония сильно различаются. 241 Ри — мягкий р-излучатель и считается безопасным. Изотопы плутония — слабые у-излучатели, и защититься от внешнего излучения сравнительно просто. Исключение составляет 244Ри, короткоживущий дочерний продукт которого — 240mNp испускает интенсивное у-излучение. Далее мы будем рассматривать опасность 239Ри.
Возможно острое и хроническое отравления плутонием. Если уровень облучения достаточно высок, ткани могут страдать острым отравлением, токсическое действие проявляется быстро. Если уровень низок, создается накапливающийся канцерогенный эффект. Поглощение 500 мг плутония как мелкораздробленного или растворенного материала может привести к смерти от острого облучения пищеварительной системы за несколько дней или недель. Вдыхание 100 мг плутония в виде частиц оптимального для удержание в легких ведет к смерти от отека легких за 1 — 10 дней. Вдыхание дозы в 20 мг ведет к смерти от фиброза за 1 мес. Для доз много меньших этих величин проявляется хронический канцерогенный эффект. Для хронического действия плутоний должен долгое время присутствовать в организме человека. Вдыхание частиц диаметром 1—3 мкм ведет к постоянному нахождению их там. Самая вероятная химическая форма, попадающая в тело, — это оксид плутония, используемый в реакторном топливе.
На протяжении всей жизни человека риск развития рака легких для взрослого зависит от количества попавшего в тело плутония. Прием внутрь 1 мкг Ри представляет риск в 1% развития рака (нормальная вероятность рака 20%). Соответственно 10 мкг увеличивают риск рака с 20 до 30%. Плутоний обычно содержится в биологических системах в степени окисления +4, имея химическое сходство с Fe3+. При проникновении в кровь он концентрируется в тканях, содержащих железо: костном мозге, печени, селезенке. Если 1,4 мкг разместятся в костях взрослого человека, в результате ухудшится иммунитет и через несколько лет может развиться рак. Норма ежегодного поглощения ~ 280 нг. Для профессионального облучения концентрация плутония в воздухе не должна превышать 7 пКи/м3. Максимально допустимая концентрация тРи (для профессионального персонала) 40 нКи (0,56 мкг) и 16 нКи (0,23 мкг) — для легочной ткани. Токсичность этого элемента сильно зависит от пути его поступления в организм. Плутоний, попавший в желудочно-кишечный тракт, менее ядовит, чем цианид или стрихнин. Для получения летальной дозы требуется 0,5 г Ри. При вдыхании его токсичность сопоставима с парами Hg или Сс1.
Для 238Pu, 239Pu, 240Ри, 242Ри, 244Ри группа радиационной опасности А, МЗА = 3,7 • 103 Бк; для 241Pu, 243Ри группа радиационной опасности Б, МЗА = 3,7 • 104 Бк. 239Ри для категории А, Р, кость ДСЛ = 7,4 102 Бк, ПДП = 77,7 Бк/год, ДКЛ= 3,3 * 10 5 Бк/л; HP, легкие ДСА = 2,9 • 102 Бк, ПДП = = 1,7−103 Бк/год.
Если радиологическую токсичность 238U принять за единицу, этот же показатель для плутония и некоторых других элементов образует ряд: 235U — 1,6; 239Pu — 5,0; 241 Am — 3,2; 90Sr — 4,8; 226Ra — 3,0. Можно видеть, что плутоний не самый опасный среди радионуклидов в отношении радиологической угрозы.
Работы с плутониевыми материалами необходимо проводить в боксе, выдерживающем помимо атмосферного давления разрежение 25 мм водяного столба, причем использовать хирургические перчатки с длинными рукавами. Отходящий из бокса воздух следует пропускать через противопылевые фильтры. При работе со значительными количествами 239Ри боксы нужно защищать плексигласовыми экранами толщиной 10 см. Поскольку «Ри диффундирует через резину перчаток, следует использовать специальные перчатки, покрытые слоем гипалона. При работе с 241 Ри боксы следует огородить со всех сторон свинцовыми экранами с толщиной стенок 3 мм и использовать окна, изготовленные из свинцового стекла толщиной 6 мм, а также радиационно стойкие перчатки.
Неотложная помощь при аварийном поступлении растворимых соединений плутония в легкие состоит в промывании носоглотки и полости рта водой; лечебные ингаляции 5%-ным раствором пентацина. Рекомендовано промывание желудка, слабительные, очистные клизмы. Дезактивация кожных покровов мыльным раствором. При глубоких колотых ранах — иссечение загрязненных участков.