Основные характеристики (макропараметры) равновесного теплового макросостояния и его термодинамическое и статистическое описание

Указанное обстоятельство, как показывает опыт, непременно сказывается на возможности дальнейшего использования энергии макрообъекта и находит свое выражение еще в одном законе сохранения в равновесных макропроцессах. Величиной, сохраняющейся наряду с энергией в равновесных макропроцессах, является энтропия. Энтропия является важнейшим макропараметром, характеризующим макросостояние и не имеющим… Читать ещё >
Основные характеристики (макропараметры) равновесного теплового макросостояния и его термодинамическое и статистическое описание (реферат, курсовая, диплом, контрольная)
Квантовая физика, введя понятие микросостояния с включением в него как объекта (микрочастица или система микрочастиц), так и окружения, способствовала рассмотрению теплового равновесия как макросостояния.
Внешнее окружение макрообъектов в условиях теплового равновесия принято называть термостатом. Предполагается, что число частиц в термостате всегда на много порядков больше, чем число частиц в рассматриваемом макрообъекте, как, например, в озере по сравнению с брошенным в него камнем. В крайнем случае, в термостат можно включить мегасистемы и даже Вселенную, т. е. расширить макросостояние до мегасостояния. Обычно свойства термостата предполагаются неизменными и подробно не описываются.
Что касается макрообъекта, то его состояние задается совокупностью макропараметров. Некоторые из них относятся к характеристикам макрообъекта самого по себе. Это внутренняя энергия, число частиц, объем, масса и т. п. Такие характеристики называют экстенсивными, так как они в равной мере имеют смысл, как для микро, так и макрообъектов.
В то же время в тепловом равновесии на опыте встречаются макропараметры иного рода. Их называют интенсивными и они отличаются тем, что имеют смысл как для макрообъекта, так и термостата. Именно они задают условие теплового равновесия при определенных контактах между макрообъектом и термостатом (см. схему 38). Это температура, давление и химический потенциал .
Схема 38. Условия теплового равновесия для определенных видов контактов между макрообъектом и термостатом.
v Механический контакт 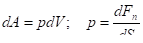 Равенство давлений:; . |
v Тепловой (энергетический) контакт. Равенство температур . |
v Корпускулярный (диффузионный) контакт. Равенство химических потенциалов:, где химический потенциал характеризует среднюю энергию, передаваемую одной частицей через границу между макрообъектом и термостатом. |
При этом очень часто выделяют тепловой (энергетический) контакт, в котором в отличие от механического контакта изменение энергии происходит на микроуровне без изменения объема макрообъекта, изменения массы вещества в целом и т. п. Такой контакт считают определяющим в равновесной термодинамике. А температуре придают универсальный смысл функции термодинамического макросостояния.
Напомним, что термодинамика (греч. therme — «тепло» и dynamic — «сила») — теория тепловых явлений, в которой макрообъект и термостат рассматривают без учета их атомно-молекулярного строения. В феноменологической термодинамике имеют дело только с макроскопическими величинами, что при условии пренебрежения флуктуациями температуры и энергии и делает термодинамику динамической теорией.
Напомним, что флуктуацией называется случайное отклонение системы от ее закономерного состояния, например, от равновесия, а также случайные отклонения измеряемых величин от их средних значений. Для наглядности представим основные законы (начала) равновесной термодинамики в схеме 39.
Схема 39. Основные начала равновесной термодинамики.
v Нулевое начало термодинамики. Если два макрообъекта А и В находятся порознь в термодинамическом равновесии с макрообъектом С и термостатом, то они находятся в термодинамическом равновесии друг с другом. Мерой термодинамического равновесия является температура Т, которая одновременно является и функцией состояния. |
v Первое начало термодинамики. Про равновесном переходе системы между двумя макросостояниями изменение внутренней энергии не зависит от вида процесса, посредством которого произведен этот переход: . |
v Второе начало термодинамики. Во всех изолированных (закрытых) системах энтропия никогда не убывает, она либо остается постоянной, либо возрастает: 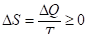 . |
v Третье начало термодинамики (теорема Нернста). При стремлении температуры макрообъекта к нулю его энтропия также стремиться к нулю независимо от значений внешних параметров: 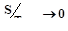 . |
Из нулевого начала термодинамики следуют важнейшие свойства температуры как характеристики макросостояния в тепловом равновесии, подтвержденные многочисленными опытами. Перечислим эти свойства температуры:
- v понятие температуры имеет смысл для макрообъектов и к отдельным микрочастицам непосредственно не применимо;
- v оно имеет четкий смысл только в тепловом равновесии и вблизи него;
- v в тепловом равновесии макрообъекты различной физической природы, погруженные в один и тот же термостат, имеют одинаковую температуру;
- v если, но соответствующие макрообъекты не находятся в тепловом равновесии. При имеет место поток энергии от объекта А1 к объекту А2;
- v все термометры в условиях теплового равновесия измеряют одну и ту характеристику, которую можно назвать температурой термостата. Тем самым температура — «это макропараметр, отражающий наличие неконтролируемого теплового воздействия на макрообъект».
Как следует из опыта, при тепловом равновесии между макропараметрами — характеристиками макрообъекта и его макросостоянием — устанавливаются устойчивые взаимосвязи. Они описываются уравнениями состояния. Простейший пример уравнение Клапейрона-Менделеева для модели идеального газа:
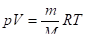
.
которому приписывается динамический характер.
При равновесных (обратимых) процессах энтропия не меняется и, следовательно, уравнения термодинамических процессов, в частности, изопроцессов, а также начала (законы) термодинамики представляют динамические закономерности, несмотря на статистический характер макропараметров и самого термодинамического макросостояния.
Первое начало термодинамики является универсальным законом сохранения энергии при равновесных тепловых процессах с указанием двух способов изменения внутренней энергии путем механической работы и теплообмена (теплопередачи энергии).
При этом возникает принципиальное различие двух способов изменения внутренней энергии на микроуровне. Механическая энергия изменяет энергию каждой микрочастицы и тем самым на ту же самую величину энергию каждой группы микрочастиц при неизменной численности групп, например, групп молекул газа. Теплообмен (теплопередача внутренней энергии) от одного макрообъекта другому связана с перераспределением микрочастиц по группам с фиксированной средней энергией, в частности, с увеличением средней численности групп молекул газа с высокой энергией.
Итак, передача энергии в форме работы — это приобретение упорядоченной, качественной энергии детерминированного движения.
Передача энергии в форме теплоты — это приобретение хаотической, некачественной энергии стохастического движения.
Указанное обстоятельство, как показывает опыт, непременно сказывается на возможности дальнейшего использования энергии макрообъекта и находит свое выражение еще в одном законе сохранения в равновесных макропроцессах. Величиной, сохраняющейся наряду с энергией в равновесных макропроцессах, является энтропия. Энтропия является важнейшим макропараметром, характеризующим макросостояние и не имеющим аналогов в механике.
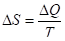
Энтропия взаимосвязана с передачей энергии в форме теплоты. По определению Клаузиуса, энтропией называется такая физическая величина, приращение которой на равно количеству тепла, полученному системой, деленному на абсолютную температуру, .
Второе начало термодинамики указывает на необратимость тепловых процессов во всех изолированных (закрытых) системах, взаимосвязанную с принципом возрастания энтропии, т. е. меры приобретения хаотической, некачественной энергии стохастического движения.
Итак, все тепловые процессы в природе необратимы, т. е. задают в случае закрытых систем направленность («стрелу времени») от порядка к хаосу. Возникает парадокс: с одной стороны равновесное тепловое макросостояние описывается динамическими закономерностями (упорядоченными взаимосвязями) макропараметрами, а с другой стороны обладает высокой степенью хаотичности, что непроизвольно приводит и к статистическим законам равновесного теплового макросостояния, связанным с тем, что каждый макрообъект состоит из известных микрообъектов — атомов, молекул, электронов и атомных ядер.
Первым обратил на это внимание Л. Больцман, задав в 1872 г. статистический смысл энтропии (см. схему 38).
Интересно, что и классическая модель хаоса — броуновское движение — так же характерна для равновесного теплового макросостояния. При этом в идеальном газе в роли броуновской частицы может выступать не только «инородный» макроскопический объект, но и любая молекула газа. Впервые беспорядочное движение мелких частиц, взвешенных в жидкости, и обусловленное случайным (хаотическим) характером воздействия на них молекул жидкости, наблюдал в 1827 г. английский ученый Роберт Броун. В 1905 г. А. Эйнштейн и М. Смолуховский дали последовательное объяснение броуновского движения на основе молекулярно-кинетической теории.
Задачу же выражения макропараметров макросостояния через известные характеристики микрообъектов, решил в 1902 г., хотя и частично, знаменитый американский физик Дж. Гиббс, введя в основное термодинамическое равенство для изменения энергии свое распределение:
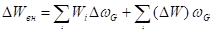
.
где — распределение Гиббса, имеющее смысл вероятности того, что микрочастица входит в состав групп с энергией в условиях теплового равновесия, характеризуемого температурой термостата. Интересно, что используя различные виды распределения Гиббса и понятие энтропии, можно вывести как классические, так и квантовые статистики.
Для наглядности представим статистические законы макросостояния в схеме 40.
Схема 40. Статистические законы макросостояния и их физический смысл.
v . | Средний радиус «миграции» броуновской частицы пропорционален корню квадратному из времени «миграции». |
v. | Энтропия макросостояния пропорциональна числу микросостояний, с помощью которых реализуется данное макросостояние (термодинамической вероятности или статистическому весу макросостояния). Энтропия выступает в качестве меры беспорядка. |
v. | 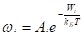 Вероятность распределения микросостояний по группам с различной энергией (распределение Гиббса). |
v. | 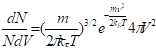 Распределение молекул газа по абсолютным значениям их скоростей (распределение Максвелла). |
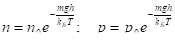 v . | Распределение молекул газа по высоте в однородном поле тяжести (распределение Больцмана). Распределение давления газа атмосферы по высоте в однородном поле тяжести в условиях теплового равновесия (барометрическая формула). |