Лабораторная работа № 3 «Тепловые эффекты реакций растворения»

Приборы и реактивы. Технические весы. Термометр. Химические стаканы. Мерные цилиндры. Конические колбы. Стеклянные палочки. Медный купорос (CuSO4). Цинковая пыль (Zn). Хлорид натрия (NaCl). Нитрат аммония (NH4NO3). Гидроксид натрия (NaOH). Вода дистиллированная. Полученный результат пересчитать на 1 моль кристаллического вещества, раствор которого готовили, и записать термохимическое уравнение… Читать ещё >
Лабораторная работа № 3 «Тепловые эффекты реакций растворения» (реферат, курсовая, диплом, контрольная)
Цель работы. Экспериментально определить тепловые эффекты реакций растворения веществ. Составить термохимические уравнения.
Приборы и реактивы. Технические весы. Термометр. Химические стаканы. Мерные цилиндры. Конические колбы. Стеклянные палочки. Медный купорос (CuSO4). Цинковая пыль (Zn). Хлорид натрия (NaCl). Нитрат аммония (NH4NO3). Гидроксид натрия (NaOH). Вода дистиллированная.
Порядок выполнения работы Опыт 1. Определение теплового эффекта реакции замещения меди из раствора ее соли цинком.
- 1. Взвесить на технических весах 5 г медного купороса и растворить в 50 мл воды. Замерить и записать температуру полученного раствора (Тн).
- 2. Взвесить 1 г цинковой пыли и всыпать ее в раствор сульфата меди.
- 3. При помощи термометра определить максимальную температуру раствора (Тк). Количество выделившегося при реакции тепла рассчитать по формуле:
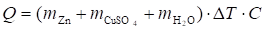
.
где ?T — изменение температуры раствора (?T = Tк — Tн), K;
C — удельная теплоемкость, Cводы = 4,18 кДж/кг•K;
m — масса веществ, кг.
4. Полученный результат пересчитать на 1 моль цинка и записать термохимическое уравнение данной реакции.
Опыт 2. Тепловые явления при растворении твердых веществ.
- 1. Налить в три стакана или колбы по 25 мл воды. Измерить температуру воды (Тн).
- 2. Взвесить на технических весах по 5 г хлорида натрия, нитрата аммония и гидроксида натрия.
- 3. Всыпать: в первый стакан хлорид натрия, во второй — нитрат аммония, в третий — гидроксид натрия (осторожно).
- 4. Навески веществ размешать в воде до полного растворения и измерить температуры полученных растворов (Тк).
- 5. По полученным данным рассчитать количество выделившейся или поглощенной при реакции теплоты по формуле:
.
где ?T — изменение температуры раствора, K (?T = Тк — Тн);
m1 — масса воды, кг;
m2 — масса кристаллического вещества, кг;
C — теплоемкость воды, C = 4,18 кДж/кг•K.
- 6. Полученный результат пересчитать на 1 моль кристаллического вещества, раствор которого готовили, и записать термохимическое уравнение данного процесса.
- 7. По полученным данным заполнить таблицу.
Таблица 3
Вещество. | Температура Т, оС. | Q, кДж. | Выводы*. | |||
начальная. | конечная. | ?Т. | ||||
- * Указать, является ли данный процесс растворения термохимическим, если да, то эндотермическим или экзотермическим.
- 8. По работе сделать вывод.