Общая характеристика структуры белковых молекул

В этом тетрапептиде остаток аланина является остатком аминокислоты, начинающей полипептидную цепь (содержит исходную аминогрупу), а остаток серина — аминокислоты, завершающий ее (содержит исходную карбоксильную группу); остатки срединных аминокислот не имеют сохраненных исходных функциональных групп по линии пептидных связей. Четвертичная структура белка состоит в пространственном расположении… Читать ещё >
Общая характеристика структуры белковых молекул (реферат, курсовая, диплом, контрольная)
Для наиболее сложных белков различают четыре структуры:
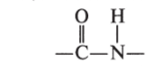
- 1. Первичная структура молекулы белка представляет собой порядок расположения остатков а-аминокислот в полипептидной цепи. Эти остатки связаны между собой пептидной связью
- (участок формулы, иллюстрирующий сущность пептидной связи).
Пептидной называют связь, возникающую между атомами, образующими карбонильную =С=0 и иминогруппу =N—Н, при этом в системе атомов О—С—N—Н— нет кратных связей и элек;
I I.
тронные облака равномерно распределяются между всеми названными атомами, придавая этой системе атомов особые свойства.
Рассмотрим образование пептидной связи на примере получения тетрапептида ала-гли-тир-серина (ала — аланин; гли — глицин; тип — тирозин):
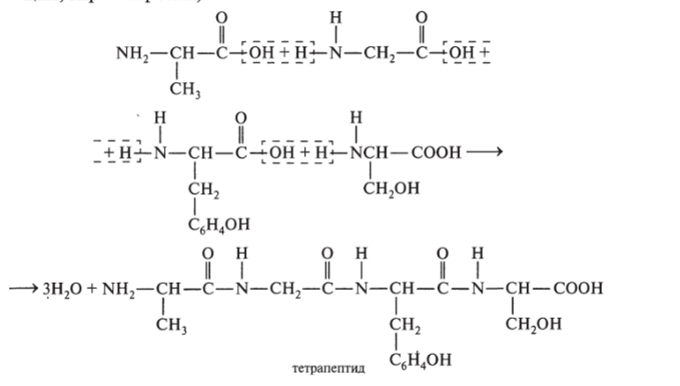
В этом тетрапептиде остаток аланина является остатком аминокислоты, начинающей полипептидную цепь (содержит исходную аминогрупу), а остаток серина — аминокислоты, завершающий ее (содержит исходную карбоксильную группу); остатки срединных аминокислот не имеют сохраненных исходных функциональных групп по линии пептидных связей.
- 2. Вторичная структура молекулы белка представляет собой расположение полипептидной цепи в пространстве. Пространственное расположение полипептидной цепи различно. Наиболее распространенной вторичной структурой является а-спираль. Альфа-спираль характеризуется строго определенным числом остатков аминокислот в витке и расстоянием между отдельными витками спирали. Устойчивость а-спирали объясняется наличием водородной связи между отдельными витками, ионной связи между —NHj и —СОО", сил внутримолекулярного взаимодействия (дипольного, диполя и неполярной частицы и двух неполярных частиц за счет дисперсионного взаимодействия), гидрофобное взаимодействие, т. е. группировка малополярных частиц в минимальном объеме за счет отталкивания их молекулами воды и другими видами связи.
- 3. Третичная структура молекулы белка представляет собой пространственное расположение альфа-спирали или других конфигураций молекулы белка.
В результате реализации третичной структуры белковой молекулы возникает субъединица ее структуры. Устойчивость третичной структуры связана с наличием тех же связей, что и во вторичной структуре.
4. Четвертичная структура белка состоит в пространственном расположении отдельных субъединиц белковой молекулы друг относительно друга. Такая структура присуща только для очень сложных белков, например гемоглобина крови.