Атомная физика.
Электромагнетизм, оптика, квантовая физика

В стеклянную трубку были вмонтированы три металлических электрода: катод, анод и сетка. Воздух из трубки откачивали вакуумным насосом, а затем она заполнялась парами ртути не очень высокой концентрации. На катод и сетку подавалось напряжение U. Таким образом в пространстве между катодом и сеткой создавалось электрическое ноле, которое ускоряло электроны, вылетавшие с поверхности нагретого током… Читать ещё >
Атомная физика. Электромагнетизм, оптика, квантовая физика (реферат, курсовая, диплом, контрольная)
БОРОВСКАЯ ТЕОРИЯ АТОМА
Спектр излучения атома водорода
Атом является составной частицей, т. е. он состоит из других частиц. Так же как любая система частиц, атом обладает внутренней энергией. которая складывается из кинетических энергий частиц, входящих в его состав, и потенциальной энергии их взаимодействия. При столкновениях атомов друг с другом или с какими-либо другими частицами кинетическая энергия поступательного движения частиц может переходить во внутреннюю энергию атомов. Такие столкновения называют ие- упругими. Когда внутренняя энергия атома увеличивается, говорят, что атом переходит в возбужденное состояние. В состояние с более низкой энергией атом может перейти самопроизвольно. При этом он испускает электромагнитные волны, уносящие часть его внутренней энергии.
В твердых телах и жидкостях атомы расположены близко друг к другу и ''сильно" взаимодействуют друг с другом. Поэтому спектры электромагнитного излучения твердых тел и жидкостей существенно отличаются от спектров излучения газов, когда источниками излучения являются практически изолированные атомы. Во второй половине прошлого века были подробно исследованы спектры электромагнитного излучения, испускаемого или поглощаемого различными атомами. Схема установки для изучения спектров электромагнитного излучения изображена на рис. 18.1.
Прибор, при помощи которого исследуют спектральный состав излучения от некоторого источника, называют спектроскопом. Если спектр регистрируют на фотопластинку, то прибор называют спектрографом. Основной частью спектроскопа является призма, изготовленная из прозрачного материала, или дифракционная решетка, после прохождения которой луч света разделяется на отдельные лучи с различными длинами волн. В схеме на рис. 18.1 источником излучения 1 служит сосуд с нагретым газом или электродуговой разряд, в котором электромагнитное излучение испускается парами какого-нибудь металла. Щель 2 формирует узкий пучок параллельных лучей. Призма 3 благодаря дисперсии света, т. е. зависимости показателя преломления вещества от длины волны, производит разделение падающего луча на монохроматические лучи, идущие под разными углами. Спектр излучения наблюдают на экране 4 или регистрируют на фотопластинке.
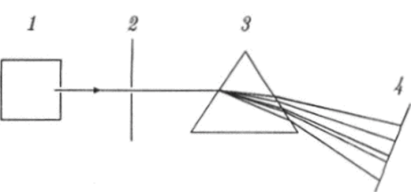
Рис. 18.1. Схема установки для наблюдения спектров излучения атомов.
Если щель освещать белым светом, то на экране будет виден сплошной спектр, в котором присутствуют все цвета радуги от красного до фиолетового. Если же источниками света являются изолированные атомы, то на экране спектроскопа наблюдаются узкие цветные линии, разделенные черными промежутками. Такой спектр называют линейчатым. Это означает, что в электромагнитном излучении, испускаемом атомами какого-либо химического элемента, присутствуют волны не всех, а только некоторых частот (или длин волн). Причем каждому элементу соответствует только для него характерный набор частот, значения которых располагаются на числовой оси в определенном порядке. Когда электромагнитное излучение проходит через газ, его атомы поглощают волны тех частот, которые они сами могут испускать. Другими словами, спектры излучения, испускаемого и поглощаемого атомами данного химического элемента, тождественны.
В конце девятнадцатого века, когда спектры излучения различных атомов были достаточно хорошо изучены, возникла необходимость их математического описания и физического объяснения. Так исследования атомных спектров привели к появлению новых представлений в физике и рождению новой науки — квантовой механики.
В 1885 г. швейцарский физик И. Бальмер установил, что длины волн видимого света, испускаемого атомами водорода очень точно описываются формулой.

где А0 — постоянная, п = 3, 4, 5, …
В настоящее время формулу Бальмера чаще записывают в виде.

где постоянную называют постоянной Ридберга в честь шведского физика И.Ридберга. Совокупность спектральных линий, частоты которых описываются формулой (18.1), называют серией Бальмера.
В 1906 г. американский физик Т. Лайман открыл, что атомы водорода испускают также электромагнитное излучение, линии которого лежат в ультрафиолетовой части спектра. Серия частот этого излучения описывается формулой.
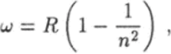
где п = 2, 3, 4,…
Дальнейшие исследования электромагнитного излучения атомов водорода показали, что, кроме серий Бальмера и Лаймана, в нем присутствуют еще несколько серий, лежащих в инфракрасной области спектра. Все частоты излучения, которое могут испускать или поглощать атомы водорода, можно описать одной формулой.

которую называют обобщенной формулой Бальмера. В этой формуле т и п — целые положительные числа, т = 1, 2, 3,…; п > т. На рис. 18.2 изображена числовая ось и, на которой отмечены некоторые частоты излучения атома водорода.
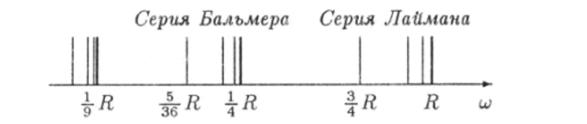
Рис. 18.2. Частоты электромагнитного излучения, испускаемого или поглощаемого атомами водорода. Спектральные серии.
В начале XX в. существование атомов было уже общепризнано. Это знание основывалось на множестве разнообразных экспериментальных данных. Было известно, что атом представляет собой систему заряженных частиц, имеющую размер порядка 10 «10 м. Был открыт электрон и установлено, что его заряд равен — е. Было известно также, что электроны входят в состав атома. Появилась необходимость в экспериментах, которые могли дать сведения о внутреннем строении атома. Задача заключалась в том, чтобы определить как распределены заряженные частицы внутри атома. Эти сведения можно было получить из экспериментов по рассеянию быстрых заряженных частиц атомами.
В 1909 — 10 годах X. Гейгер и Э Марсден провели эксперименты по рассеянию а-частиц в тонких металлических пленках. Схема этого эксперимента приведена на рис. 18.3.
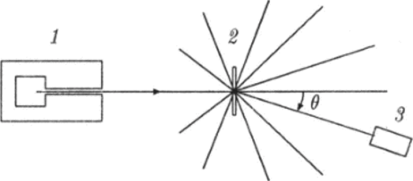
Рис. 18.3. Схема установки для изучения рассеяния а-частиц в веществе.
Узкий пучок а-частиц от радиоактивного источника 1 направлялся на тонкую мишень 2 из исследуемого вещества. После взаимодействия с атомами мишени а-частицы отклонялись на различные углы относительно направления своего первоначального движения. По угловому распределению рассеянных а-частиц можно составить представление о строении атома. Количества а-частиц. отклонившихся на определенные углы, измерялись при помощи сцинтилляционного счетчика. Сцинтиллятор — это вещество, при ударе о которое а-частица вызывает вспышку света (сцинтилляцию). Эти вспышки наблюдали в микроскоп. Было установлено, что некоторое количество а-частиц при столкновениях с атомами рассеивается на очень большие углы (больше 90°), как будто внутри атома имеется ''твердая" сердцевина.
Еще в 1906 г. английский физик Э. Резерфорд экспериментально доказал, что а-частица есть дважды ионизированный атом гелия, т. е. ачастица — это положительно заряженная частица, которая превращается в атом гелия, когда к ней присоединяются два электрона. Следовательно, заряд а-частицы равен +2е. В 1911 г. Резерфорд вывел формулу, описывающую угловое распределение а-частиц после их рассеяния на положительно заряженных частицах. Эта формула с высокой точностью описывает угловое распределение а-частиц, наблюдаемое в опытах по их рассеянию атомами различных элементов. Согласие полученной формулы с результатами опытов позволило Резерфорду утверждать, что положительный заряд и почти вся масса атома сосредоточены в области, размер которой существенно меньше размеров самого атома и составляет величину порядка 10″ 14 м. Эту область назвали ядром атома. Из формулы Резерфорда следовало, что заряд ядра должен быть равен + Ze, где Z — порядковый номер элемента в периодической таблице Менделеева. Резерфорд предложил рассматривать атом как некоторое подобие Солнечной системы. По его представлениям вокруг атомного ядра, как планеты вокруг Солнца, движутся Z электронов. Атом в целом нейтрален, так как отрицательный заряд всех его электронов равен по величине заряду ядра. Такая модель атома называется планетарной.
Итак, опыты по рассеянию а-частиц атомами свидетельствуют в пользу планетарной модели атома. Однако согласно законам механики и электростатики система заряженных частиц может быть устойчивой, т. е. может существовать самостоятельно длительное время, не изменяя своего состояния, только при условии, что входящие в ее состав частицы находятся в постоянном движении. Так, например, планеты не падают на Солнце и не удаляются от него на большие расстояния потому, что движутся вокруг Солнца по орбитам, похожим на эллипсы. Когда частицы движутся в пределах конечного объема, их движение непременно будет ускоренным. По законам классической электромагнитной теории ускоренно движущиеся заряженные частицы испускают электромагнитные волны, которые непрерывно уносят с собой энергию этих частиц. Следовательно, атом как система ускоренно движущихся заряженных частиц должен постоянно излучать электромагнитные волны и при этом терять свою энергию. Из этого следует парадоксальный вывод, что атом является неустойчивой системой. Разумеется, этот вывод находится в полном противоречии с действительностью. Более того, в рамках классической электромагнитной теории не удается правильно объяснить строение спектров излучения атомов. Эти противоречия обусловили необходимость формирования новых представлений и отыскания новых законов, на которых должна быть основана теория строения атома.
В 1910;14 годах немецкие физики Джеймс Франк (1882−1964) и Густав Герц (1887−1975) осуществили опыты по столкновениям электронов с атомами газов, которые явились прямым доказательством дискретности внутренних состояний атомов (Нобелевская премия 1925 г.). Схема их установки приведена на рис. 18.4.
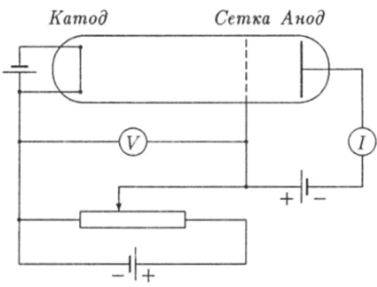
Рис. 18.4- Схема опытов Франка и Герца.
В стеклянную трубку были вмонтированы три металлических электрода: катод, анод и сетка. Воздух из трубки откачивали вакуумным насосом, а затем она заполнялась парами ртути не очень высокой концентрации. На катод и сетку подавалось напряжение U. Таким образом в пространстве между катодом и сеткой создавалось электрическое ноле, которое ускоряло электроны, вылетавшие с поверхности нагретого током катода вследствие термоэлектронной эмиссии. В пространстве между сеткой и анодом создавалось другое, более слабое электрическое поле, которое замедляло движение электронов, проникавших в эту область сквозь сетку. Только те электроны из числа проникших сквозь сетку достигали поверхности анода, кинетическая энергия которых была больше потенциальной энергии eU3, приобретаемой ими при движении в электрическом поле от сетки к аноду. Здесь U3 — задерживающее напряжение между сеткой и анодом. Эти электроны создавали в цепи электрический ток, сила которого I измерялась посредством гальванометра. Целью измерений было снятие вольт-амперной характеристики, т. е. зависимости силы анодного тока 1 от напряжения между катодом и сеткой. Результаты этих измерений представлены графиком зависимости / = I (U) на рис. 18.5.
При увеличении напряжения U от значения U — 0 сила тока 1 в цепи анода сначала монотонно возрастает, достигает максимума при некотором значении напряжении U0i затем резко падает, достигает минимума и снова начинает возрастать, достигая второго максимума при значении напряжения 2U0. Следующий максимум силы анодного тока соответствует значению напряжения Wa и т. д. Такой характер зависимости силы тока от ускоряющего электроны напряжения можно объяснить следующим образом.
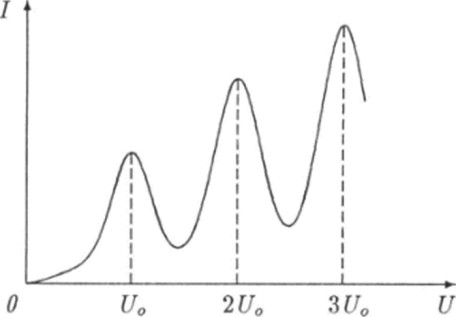
Рис. 18.5. Зависимость силы тока I в цепи анода от напряжения U между катодом и сеткой.
Электроны, летящие от катода, сталкиваются с атомами ртути. Столкновение, после которого внутренняя энергия атома не изменяется, называют упругим. В зависимости от условий столкновения кинетическая энергия электрона после упругого столкновения может как уменьшиться, так и увеличиться. Но в любом случае она изменяется незначительно. Относительное изменение кинетической энергии электрона после упругого столкновения с атомом равно по порядку величины отношению массы электрона к массе атома, т. е. те/та 10″4. Таким образом, кинетическая энергия электрона в упругих столкновениях с атомами газа практически не изменяется.
Столкновение электрона с атомом, после которого изменяется внутреннее состояние последнего, называют неупругим. Возникает вопрос, какие значения может принимать внутренняя энергия атома? Если она может принимать любые значения, то при неупругом столкновении с электроном атом может принять от него (или отдать ему) любую часть энергии. В этом случае наблюдаемая в опытах Франка и Герца зависимость / = /(?/) не поддается объяснению.
Предположим, что состояния атома дискретны, т. е. их можно перенумеровать. При этом энергия атома может принимать не любые, а только вполне определенные значения Е. Е2, Ез…каждое из которых соот ветствует какому-то состоянию атома. В таком случае при неупругом столкновении с электроном энергия атома может измениться только на величину ДЕ} которая равна разности каких-либо двух из возможных значений внутренней энергии атома Е, ?2, Ез,.
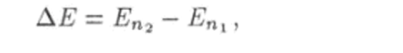
где п, n2 = 1, 2, 3,…
Пусть есть наименьшее значение внутренней энергии атома. Состояние, в котором атом обладает такой энергией, называют основным. Все другие состояния атома называют возбужденнъиии. Пусть Е2 — наименьшее значение энергии атома в возбужденном состоянии. Следовательно, наименьшее значение энергии, которую может принять от электрона при неупругом ударе находящийся в основном состоянии атом, равно.
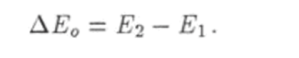
Если кинетическая энергия налетающего на атом электрона меньше Д Е0:

то внутренняя энергия атома после столкновения не изменится, т. е. столкновение будет упругим. Так как кинетическая энергия электрона после упругого столкновения с атомом практически не изменяется, при движении электрона от катода к сетке она под действием ускоряющего электрического поля будет постепенно увеличиваться. Подлетающий к сетке электрон приобретает наибольшую кинетическую энергию, которая связана с напряжением U между катодом и сеткой сооношением.

С учетом этого соотношения условие (18.3), при выполнении которого происходят только упругие столкновения электронов с атомами, можно записать как.

Из этого неравенства следует, что до тех пор, пока напряжение U меньше значения.

при увеличении U будет увеличиваться кинетическая энергия (18.4) подлетающих к сетке электронов и вследствие этого будет возрастать доля электронов, которые преодолевают пространство между сеткой и анодом, где имеется тормозящее их движение электрическое поле, т. е. будет расти сила анодного тока /.
Когда напряжение U немного превысит значение U0 и кинетическая энергия (18.4) подлетающих к сетке электронов станет несколько больше АЕ0у некоторые электроны при столкновениях с атомами будут отдавать им почти всю свою энергию. Такие электроны, даже если они пролетят сквозь сетку, не смогут достичь анода. До анода будут долетать только электроны, которые не испытали неупругих столкновений с атомами. Чем больше напряжение U, тем больше кинетическая энергия электронов и тем большее число электронов теряют свою энергию в неупругих столкновениях с атомами. Поэтому при U > U0 сила тока в цепи анода начинает уменьшаться при увеличении напряжения U.
При напряжениях U > U0 вылетающие с катода электроны приобретают кинетическую энергию.
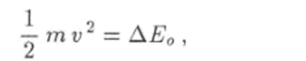
когда расстояние до сетки еще достаточно велико. В таком случае электрон после неуиругого соударения с атомом на пути к сетке еще успевает ускориться и приобрести кинетическую энергию, достаточную для преодоления тормозящего поля между сеткой и анодом. Но этой причине начинается новый рост силы анодного тока при дальнейшем увеличении напряжения U.
Напряжение U0 называется первым потенциалом возбуждения атома. Атом, получивший при столкновении с электроном энергию АЕ0 = е (/0, переходит в возбужденное состояние. Спустя некоторое время (~ 10″ 8 с) он самопроизвольно возвращается в основное состояние. При этом атом испускает квант электромагнитного излучения частоты о/ = AE0/h.
При напряжении U между катодом и сеткой, которое немного превышает значение 2U0, электрон после одного неупругого столкновения с атомом подлетает к сетке с кинетической энергией, достаточной для второго неупругого столкновения. В этом столкновении он теряет почти всю свою энергию и поэтому не долетает до анода. При увеличении напряжения U все больше электронов на пути от катода к сетке испытывают неупругие столкновения с атомами ртути дважды. Поэтому сила анодного тока снова начинает уменьшаться. Аналогичные опыты были проведены с атомами других химических элементов. Все они дали такие же результаты, которые убедительно доказали, что внутренние состояния атомов дискретны. Эти результаты не согласуются с представлениями и законами классической механики, что послужило еще одним поводом к созданию новой теории строения атома.
В 1913 г. датский физик Нильс Бор создал первую квантовую теорию атома (Нобелевская премия 1922 г.). В основу этой теории была положена планетарная модель атома. Однако Бор высказал совершенно новые идеи относительно характера движений электронов в атоме. Он предположил, что стационарное движение электронов в атоме происходит по определенным правилам, которые были им сформулированы в виде двух постулатов.
- 1. Электроны в атоме могут двигаться только по некоторым «разрешенным» орбитам, названным стационарными. Причем эти орбиты можно перенумеровать. Двигаясь по одной из таких орбит, электрон вопреки законам классической электромагнитной теории не излучает электромагнитные волны. При этом его энергия Е не изменяется и принимает одно из возможных значений, которые образуют дискретный спектр Е, #2″ ?з, •••
- 2. Электрон за очень короткое время может перейти с одной стационарной орбиты на другую. Такой переход сопровождается испусканием или поглощением кванта электромагнитного излучения (фотона), энергия которого flu равна разности энергий электрона до и после перехода:

где п 1 и «2 «номера орбит. Испускание фотона атомом происходит в том случае, когда при переходе электрона с одной орбиты на другую его энергия уменьшается. Следствием поглощения фотона атомом является переход электрона на орбиту, где его энергия больше.
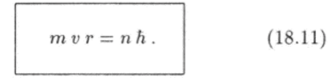
Бор предложил так называемое правило квантования орбит, которому должны удовлетворять стационарные орбиты электронов в атоме. Согласно этому правилу при движении электрона по стационарной орбите его момент импульса L равен целому числу постоянных Планка h:

где целое число п = 1, 2, 3, … называют квантовым числом.
Теория Бора дала замечательные результаты при описании атома водорода, состоящего из протона с зарядомНей электрона, и водородоподобного иона, который состоит из ядра произвольного элемента и одного электрона. Так как масса ядра много больше массы электрона, ядро можно считать неподвижным, а электрон — движущимся вокруг него. Заряд ядра равен +Ze, где Z — порядковый номер элемента в таблице Менделеева. Поэтому на электрон, заряд которого равен — е, со стороны.

где г — расстояние между ядром и электроном.
Рассмотрим движение электрона вокруг ядра по окружности радиуса г (рис. 18.6). Запишем второй закон Ньютона:
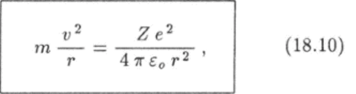
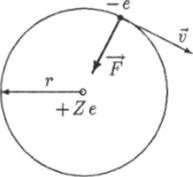
Рис. 18.6.
Водородоподобный ион
где 771 и v — масса электрона и его скорость.
Правило квантования (18.8) теперь можно записать так:
Второй закон Ньютона (18.10) и постулат Бора (18.11) образуют систему из двух уравнений с двумя неизвестными у и г. Найдем решение этой системы. Для этого разделим первое уравнение на второе. Получим.
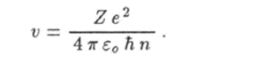
Найдем теперь радиус орбиты электрона из уравнения (18.11). После простых преобразований придем к формуле.
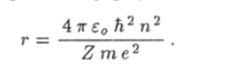
Как видно из этой формулы, радиус орбиты электрона зависит от числа п. Поэтому число п рассматривают в качестве номера орбиты. Радиус первой орбиты, для которой n = 1, в атоме водорода (Z = 1) можно вычислить по формуле.
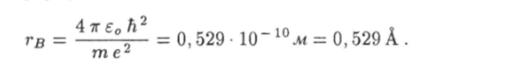 aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">
aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">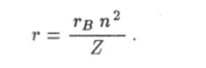
Это значение называют воровским радиусом. Используя это обозначение, формулу для радиуса n-й орбиты электрона в водородоподобном ионе можно записать как Внутренняя энергия Е водородоподобного иона есть полная механическая энергия электрона, движущегося вокруг неподвижного ядра. Кулоновскому взаимодействию электрона с ядром соответствует потенциальная энергия 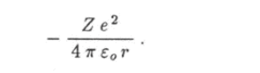
Поэтому полная механическая энергия электрона.
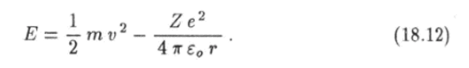
Из уравнения Ньютона (18.10) следует, что абсолютное значение потенциальной энергии электрона равно его удвоенной кинетической энергии:
Следовательно, 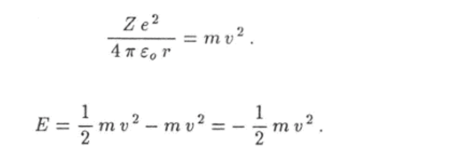
Таким образом, энергия электрона в водородоподобном ионе равна по величине и противоположна по знаку его кинетической энергии. Используя полученную выше формулу для скорости электрона, придем к следующему выражению для энергии электрона в водородоподобном ионе:
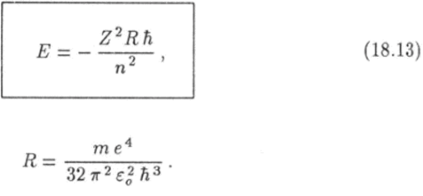
где тел
32*2*2/13 •.
Подстановка в эту формулу известных значений фундаментальных постоянных приводит к значению Я, которое с высокой точностью соответствует экспериментальному значению постоянной Ридберга. Согласно формуле (18.13) энергия электрона тем больше, чем больше квантовое число п.
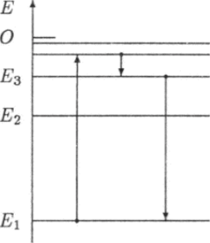
Значения энергии электрона в атоме отмечают отрезками прямых линий на числовой оси Е (рис. 18.7). Эти отрезки называют уровнями энергии электрона.
Рис. 18.7. Спектр энергий электрона в водородоподобном ионе. Стрелками условно обозначены переходы электрона с одной орбиты на другую
На рис. 18.8 изображены стационарные орбиты электрона в водородоподобном ионе. Когда электрон переходит на орбиту меньшего радиуса, его энергия уменьшается. При этом атом испускает фотон.
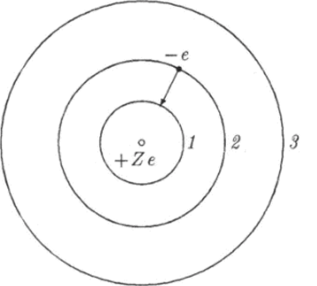
Рис. 18.8. Стацгюнарные орбиты электрона в водородоподобном ионе
Процесс испускания атомом фотона описывают уравнением.
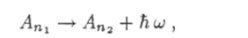
где символ АПх обозначает атом в состоянии, которое характеризуется квантовым числом п} а символ Л"2 — атом в состоянии г?2- Испускание фотона атомом подобно выстрелу снарядом из пушки (рис. 18.9).
Очевидно, что атом АПх может испустить фотон только в том случае, когда его энергия ЕПх больше энергии ?Пз, которой он будет обладать после испускания фотона. Это условие выполняется, если п > П2- При этом энергия hw фотона, испущенного атомом, равна разности энергий электрона в начальном и конечном состояниях:
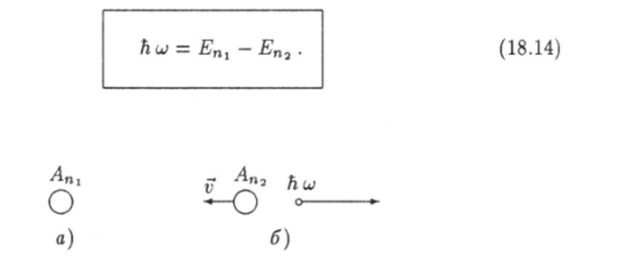
Рис. 18.9. Испускание фотона атомом.
Процесс поглощения фотона атомом (рис. 18.10) описывают уравнением 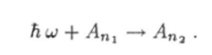
В этом процессе фотон отдает всю свою энергию поглощающему его атому. Вследствие этого энергия атома увеличивается на величину hu:

где П2 > п. Атом переходит в возбужденное состояние, а электрон — на орбиту большего радиуса.

Рис. 18.10. Поглощение фотона атомом.
Подставив выражение (18.13) для энергии электрона в атоме водорода (Z = 1) в равенства (18.14) и (18.15), придем к формуле (18.2) для спектра частот излучения, испускаемого или поглощаемого атомом водорода.
Атомы других химических элементов устроены более сложным образом, чем атом водорода и водородоподобный ион. В этих атомах вокруг ядра вращаются несколько электронов. В рамках теории Бора не удается правильно описать многоэлектронный атом, даже атом гелия, в котором имеется всего два электрона.