Квантовые числа.
Химия

Необходимость введения побочного квантового числа подтверждена изучением спектра атома водорода. Спектральные линии, отвечающие переходам с одного уровня на другой, часто состоят из нескольких близко расположенных отдельных линий. Причем первая линия, соответствующая п = 1, состоит только из одной линии. Линия сп = 2 включает две линии, или, как говорят, расщеплена на две линии. Линия с п = 3… Читать ещё >
Квантовые числа. Химия (реферат, курсовая, диплом, контрольная)
Вероятность нахождения электрона в некоторой области вблизи ядра определяется энергетическим состоянием электрона. Электрон может находиться в любом месте пространства — даже в ядре атома и в бесконечном удалении от него. Однако в атоме имеются области, где вероятность его нахождения выше, и там он пребывает чаще. Эти области соответствуют пониженной (даже минимальной) энергии электрона.
Совокупность мест (точек) пространства, где вероятность нахождения электрона велика (максимальна), называется электронным облаком атома, его электронной оболочкой, которую можно называть его электронной орбиталью. Па основе квантового характера энергетических изменений, корпускулыю-волнового дуализма и принципа неопределенности квантовая теория описывает движение электрона в атоме волновой функцией, входящей в уравнение Шрёдингера (1926), которое описывает движение одного электрона в поле протона, т. е. в атоме водорода. Уравнение Шрёдингера и его решение можно найти в курсах химии и физики.
Эрвин Шрёдингер (1887—1961) — австрийский физик-теоретик. В 1920 г. предложил квантовую теорию света, положив начало современной колориметрии. В 1926 г. предложил уравнение, впоследствии названное его именем, описывающее изменение во времени волновой функции и состояние квантовых объектов. Уравнение отражает корпускулыю-волповой дуализм микрочастиц, высказанный в 1924 г. де Бройлем. Уравнение Шрёдингера подобно уравнению, описывающему колебания натянутой струны, но отличие состоит в том, что квадрат волновой функции равен вероятности нахождения частицы в точке данного пространства и при определенном квантовом состоянии системы. Из уравнения по известному значению волновой функции находят ее значение в другой момент времени. Уравнение Шрёдингера объясняет большое число явлений атомной физики, а также многие явления ядерной физики, например альфа-распад ядер, гамма-излучение ядер, рассеяние нейтронов на ядрах. В 1945 г. Э. Шрёдингер опубликовал популярную, но глубоко научную книгу небольшого объема «Что такое жизнь с точки зрения физики?» («What is life? The physical aspect of the living cell»). Книга поразила науку всего мира своей невероятной новизной. Книга была написана по лекциям, прочитанным в Тринити-колледж в Дублине в феврале 1943 г. Приводим названия некоторых глав: «Механизм наследственности», «Мутации», «Упорядоченность, неупорядоченность и энтропия», «Основана ли жизнь на законах физики?» Когда я был студентом, меня «пронзила» и поражает сегодня, казалось бы, простая мысль: «Живой организм питается отрицательной энтропией», и я решил изучать химию белка. Книга не утратила своего научного значения и сегодня.
Решение уравнения Шрёдингера приводит к трем сериям ответов, представляющих собой три вида связанных между собой квантовых чисел, которые определяют энергетическое состояние электрона и распределение электронной плотности в пространстве вокруг ядра атома. Квантовые числа обычно выражают без единиц измерения.
1. Первая серия решений уравнения Шрёдингера дает значения главного квантового числа /?, которое может принимать значения целых чисел от 1 до бесконечности: п = 1, 2, 3,.
Главное квантовое число характеризует общую энергию электрона на данной орбитали. В химии пользуются семью первыми значениями главного квантового числа: п = 1+7. Бесконечно большое значение п говорит о том, что электрон находится на бесконечно большом расстоянии от ядра, т. е. является свободным, не связанным с ядром. (В-1−74. Как вы думаете, каков смысл п = О?) Значения главного квантового числа характеризуют главные энергетические уровни электрона.
Максимальное значение п для данного атома в его невозбужденном состоянии совпадает с номером периода периодической таблицы элементов. Например, если элемент находится в пятом периоде, то его электроны занимают пять энергетических уровней.
2. Вторая серия решений дает значения побочного, или орбитального, квантового числа /, которое может принимать значения от нуля до п — 1: /= 0, 1, 2,…, п — 1.
Необходимость введения побочного квантового числа подтверждена изучением спектра атома водорода. Спектральные линии, отвечающие переходам с одного уровня на другой, часто состоят из нескольких близко расположенных отдельных линий. Причем первая линия, соответствующая п = 1, состоит только из одной линии. Линия сп = 2 включает две линии, или, как говорят, расщеплена на две линии. Линия с п = 3 расщеплена на три близко расположенные линии и т. д. Это указывает на небольшие энергетические различия электронов одного и того же энергетического уровня (кроме первого).
Все уровни с п от 2 до 7 разделены (расщеплены) на несколько энергетических подуровней, и поэтому уровни, кроме первого, состоят из подуровней, которые обозначают буквами sypydnf соответственно значениям / = 0, 1, 2 и 3. Первый энергетический уровень п = 1 не расщеплен, и его обозначают буквой s.
При п = 2 побочное квантовое число принимает значения 0 и 1. Это означает, что этот уровень состоит из двух подуровней — 5 и р. При п = 3 побочное квантовое число / принимает три значения: 0, 1 и 2. Поэтому считается, что третий энергетический уровень состоит из трех подуровней — s, p и d. При п = 4 побочное квантовое число / имеет четыре значения: 0, 1, 2 и 3, из чего следует, что четвертый энергетический уровень включает четыре подуровня — s, p, d и /.
Таблица 1.5
Главные и побочные квантовые числа.
п | Обозначение подуровня. | |
0, 1. | 25, 2р | |
0,1,2. | 35, 3/9, 3d | |
0, 1,2,3. | 45, 4р, 4 dy Af |
Число подуровней в каждом уровне равно его главному квантовому числу. В табл. 1.5 приведены значения главного квантового числа пу соответствующие им побочные квантовые числа и обозначения отвечающих им подуровней.
Орбитальное квантовое число, кроме указания на энергетическое расщепление уровня, определяет форму поверхности максимальной вероятности нахождения электрона в некоторой области вблизи ядра. Сферическую (шаровую) поверхность имеют 5-орбитали, другие орбитали имеют иную форму.
3. Третья серия решений определяется магнитным квантовым числом Шу зависящим от побочного квантового числа / и принимающим значения от -/, проходя через нуль, до +/: т = -/,…, 0,1,…, +/.
Эти квантовые числа отвечают числу орбиталей на каждом подуровне.
Число орбиталей с данным значением / равно 21 + 1 (табл. 1.6).
Таблица 1.6
Орбитали и магнитное квантовые числа.
т | Число орбиталей. | Обозначение. | |
— 1,0,1. | Р | ||
— 2,-1,0, 1,2. | d | ||
— 3, -2,-1,0, 1,2,3. |
Физический смысл магнитного квантового числа заключается в том, что в спектрах атомов у электронов, находящихся во внешнем магнитном поле, обнаруживается дополнительное расщепление спектральных линий. Возникновение новых близколежащих линий свидетельствует о том, что в магнитном поле энергия электронов изменяется.
В магнитном поле 5-подуровень не расщепляется. Это говорит о том, что все 5-электронные облака имеют одинаковую форму, а именно шаровую, что показано на рис. 1.5, а. На этом и последующих рисунках изображены кривые, показывающие наиболее высокую вероятность нахождения электрона в пространстве вблизи ядра.
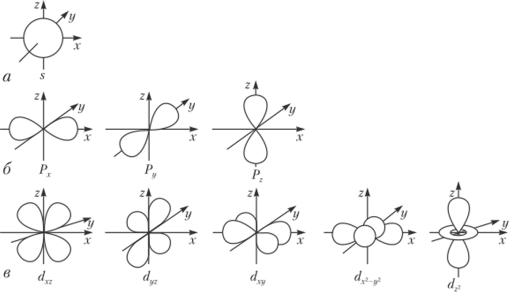
Рис. 1.5. Форма электронных оболочек (орбиталей).
Спектральные линии-подуровней расщепляются в магнитном ноле на три близко лежащие линии. Это указывает на три различные ориентации р-облаков в пространстве. Расчеты показывают, что области максимального значения вероятности нахождения р-электронов похожи на поверхность гантели. Так как возможны три различных направления расположения р-орбиталей в пространстве, то удобно расположить их вдоль координатных осей х, у и г, и орбитали обозначить рх, pf/ и рг(рис. 1.5, б). Все р-орбитали энергетически равноценны (в изолированном атоме).
Спектральные линии (/-подуровней расщепляются в магнитном поле на пять близко лежащих линий, что указывает на пять ориентаций и форм (/-облаков в пространстве (рис. 1.5, в). Несмотря на различную форму (/-облаков, они энергетически равноценны.
Спектральные линии /-подуровней в магнитном поле расщепляются на семь близких линий, поэтому /-подуровень состоит из семи энергетически равноценных орбиталей. Форма /-облаков очень сложна.
Принято электронную орбиталь изображать квадратиком (иногда — кружком). Такой квадратик называют электронной ячейкой или просто ячейкой. Электроны s-подуровня имеют одну ячейку, р-подуровня — три, (/-подуровня — пять и /-подуровня — семь ячеек (квадратиков), как показано на рис. 1.6.
Энергетические электронные подуровни обозначают буквами s, р, d и / а цифрой перед буквой указывают номер уровня (главное квантовое число). Например, запись 3р означает, что речь идет о р-подуровне третьего уровня, т. е. п = 3, / = 1.
В невозбужденном атоме водорода единственный электрон находится на орбитали Is. При возбуждении в зависимости от количества полученной энергии электрон может занять любой стоящий.
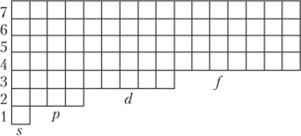
s.
Рис. 1.6. Электронные ячейки. Распределение электронов по энергетическим уровням (1—7) и s-, p-, d- и/-подуровням выше подуровень. При обратном переходе из возбужденного состояния в невозбужденное основное состояние электрон выделяет эту энергию, испуская кванты соответствующей частоты.
Переход из возбужденного состояния в не возбужден нос (основное) необязательно совершается непосредственно, а чаще проходит последовательно через промежуточные по энергии уровни и подуровни.
Энергия электрона возрастает при переходе на вышестоящие уровень и подуровень. Когда на одном уровне имеется несколько подуровней 5, р, d и /, их энергия возрастает от .v-подукровня к /-подуровню. На рис. 1.7 изображена (без соблюдения масштаба) энергетическая диаграмма уровней и подуровней атома водорода.
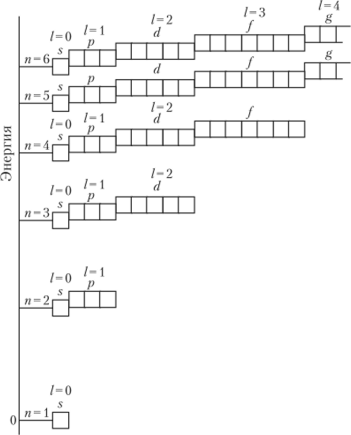
Рис. 1.7. Энергетическая диаграмма электронных уровней и подуровней атома водорода.
Для описания поведения одного электрона в атоме водорода достаточно трех квантовых чисел. Для многоэлектронных атомов необходимо введение четвертого квантового числа и целого ряда новых теоретических предпосылок.